I lipopolissaccaridi, o endotossine, sono componenti della parete cellulare dei batteri Gram negativi che costituiscono una minaccia spesso sottostimata per i suini. Vari suggerimenti possono aiutare a limitare il loro impatto negativo.
Dati di fatto

Lipolisaccaride (LPS), maggior determinante patogenico dei batteri gram negativi, é il solo costituente lipidico dello strato esterno e costituisce fino al 75% della struttura della parete cellulare, con una presenza media di 2 x 106 molecole di LPS per cellula batterica e circa il 10% del peso dell’organismo. LPS é componente essenziale della parete cellulare batterica ed é prerequisito per la sopravvivenza cellulare; serve come barriera potenziale contro antimicrobici nella memmbrana esterna dei batteri Gram negativi. LPS sono differenti secondo i diversi batteri, la variabilità è a carico della catena pi§ esterna del polisaccaride O-specifico che caratterizza anche antigenicamente i tipi e ceppi batterici, conferendo una minore o maggiore aggressività e/o patogenicità.
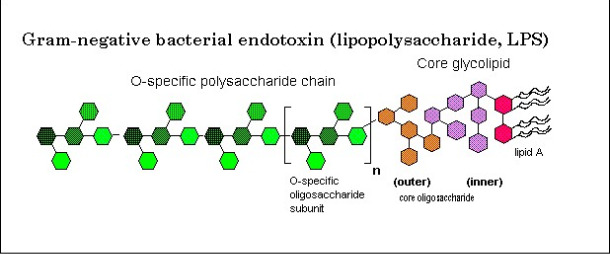
Figura 1. Struttura del lipopolisaccaride. La figura illustra la struttura di un lipolisaccaride che contiene una parte lipidica pirogenica che é incastonata nella parete cellulare, un nucleo oligosaccaride interno ed esterno, e un antigene O catena polisaccaridica doppia. (Fonte: Biomin).
La variabilità é anche data dalla differente suscettibilità delle differenti linee genetiche suine.
Ciò che rende LPS speciale é che i meccanismi bilogici per riconoscere e reagire al LPS sono più caratteristici di un ormone che di una tossina. Nei mammiferi esiste una proteina di trasporto dedicata (LPB), un complesso recettore cellulare (TLR4) ed un sistema di risposta antagonista specifici alla tossina.
LPB é una proteina della fase acuta dell’ infiammazione indotta da IL-6 e IL-1. Oltre al fegato, anche polmoni, reni e cuore sono coinvolti nella produzione della LPB.
Lipopolisaccaridi sono anche detti endotossine perché rilasciati dopo replicazione o lisi (morte) batterica: sono presenti dappertutto inclusi terreno, aria e acqua. I suini sono continuamente esposti al LPS per tutta la vita. Negli animali sani, l’epitelio intestinale ed altri epiteli come su pelle e polmoni, rappresentano una barriera efficiente che previene il passaggio del LPS nel comparto sanguigno. Una volta lì, comunque, le endotossine possono provocare forti reazioni immunitarie, indebolendo i sistemi immunitari e compromettendo i risultati zootecnici. Una risposta immunitaria molto forte può condurre a shock settico.
Nel suino, le endotossine sono ben note nel provocare incrementi di temperatura corporea, dose dipendenti, di 1- 1,5°C, ridotti livelli di attività, minor assunzione di cibo fino a grave anoressia.
Effetti sull’intestino
L’intestino é la prima linea di difesa contro le endotossine e, se l’integrità viene compromessa a causa della nutrizione, lo stress o lo stato metabolico, il trasporto di endotossine può aumentare; per esempio, lo stress da calore aumenta la permeabilità intestinale. La restistenza trans-epiteliale (TER o TEER) del monostrato di cellule delle membrane epiteliali intestinali é un buon indicatore del grado di organizzazione delle giunzioni strette intercellulari e in ultima analisi dell’integrità intestinale. La perdita di integrità intestinale e dell’ organizzazione delle giunzioni strette viene dimostrata attraverso la modificazione della TER in suini intossicati con endotossine in confronto ad un campione negativo. Il Lps é quindi in grado di diminuire la TER diminuendo l’espressione delle giunzioni strette, attraverso la mobilizzazione della citochina TNFα responsabile di tale effetto. L’effetto viene riscontrato principalmente nel tratto digiuno del tenue, con un effetto di accorciamento dei filamenti di actina negli enterociti (vedi fig. 2) e interrompendo la struttura delle giunzioni strette; la TER viene ridotta e così viene aumentato il trasporto para-cellulare indiscriminato di molecole, così come la fuoriuscita di patogeni, nel sistema circolatorio. Le Malattie intestinali e sistemiche sono associate alla permeabilità della barriera epiteliale (leaky gut) e aumenta la permeabilità intestinale all’endotossina. Il LPS può essere assorbito attraverso l’epitelio intestinale verso la circolazione sistemica per via paracellulare come visto e per via transcellulare: la prima via resta la più frequente. Il trasporto transcellulare avviene tramite endocitosi mediata da recettori o per diffusione micellare assistita di alimenti grassi.
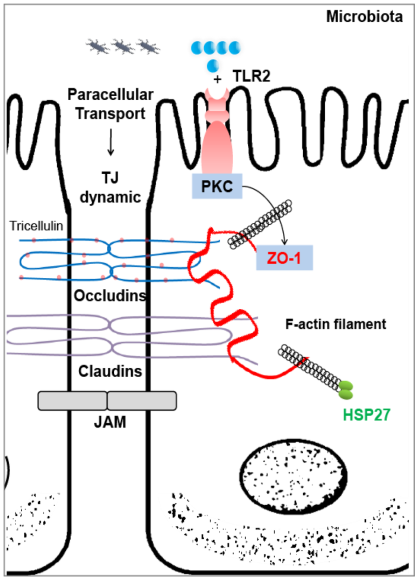
Figura2: la figura rappresenta enterociti con la struttura delle giunzioni strette ed il filamento di actina che supporta la struttura. (Haoyu Liu et al.,Pathogens 2014)
L’intossicazione da endotossina porta a ridotto assorbimento intestinale a carico di alcuni zuccheri (fruttosio e galattosio), aminoacidi (leucina), similarmente alla citochina TNFα per il galattosio.

E’ stato dismostrato che i chilomicroni intestinali, coinvolti nel trasporto degli acidi grassi assorbiti, promuovono l'assorbimento dell’endotossina, ma aiutano anche nella coniugazione di LPS ai Sali biliari.
Effetti negativi
Il LPS viene trasportato nel sangue dalla proteina specifica che lo lega (LPB), sintetizzata nel fegato e nelle cellule epiteliali intestinali come reagente della fase acuta dell’infiammazione; in minor misura é trasportato anche dalle albumine. Una volta legato é in grado di attivare il recettore specifico TLR4 ed inizializzare la cascata della kinasi ed il complesso del fattore di trascrizione NK-kB: in questo modo, diverse centinaia di geni vengono trascritti per scatenare la risposta infiammatoria.
Le citochine proinfiammatorie possono anche aumentare la secrezione di Cl- nelle cripte e diminuire l’assorbimento di Na+, causando perdita di liquidi nel piccolo intestino; TNFα é in grado di influenzare un ATPasi Na/K che regola questo processo.
Una volta entrate nella circolazione sanguigna, le endotossine sono trasportate attraverso la vena porta al fegato dove avviene la maggior parte del lavoro di detossificazione. Se la quantità di endotossine che entrano si formano nel tratto gastrointestinale supera la capacità detossificante del fegato, ne deriva endotossiemia, il LPS induce rapidamente effetti di infezione acuta sistemica.
I fenomeni clinici che precedono lo sviluppo della sepsi o dello shock septico sono molto complessi. Paradossalmente, suini con sistema immunitario indebolito sviluppano più probabailmente sepsi, ma i processi nocivi che possono portare alla fine alla morte dell’animale, sono per lo più causati da una risposta sistemica esagerata all’infezione.
Le endotossine causano una cascata infiammatoria che aumenta il fabbisogno fisiologicio di base (mantenimento) del suino, dovuto alla febbre, associato a ridotta assunzione di cibo, cioè meno energia é disponibile per l’accescimento. Una ricerca ha dimostrato che suini intossicati con LPS avevano il 13% minor accrescimento medio giornaliero (figura 3) in confronto al gruppo di controllo.
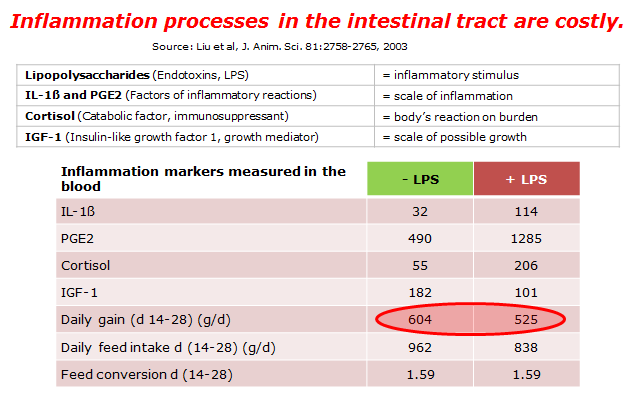
Fig 3. Più infiammazione meno crescita (fonte: Lieu et al., 2003)
I mammiferi hanno sviluppato un sistema elaborato per tollerare e detossificare le endotossine sia sulla superficie della mucosa intestinale o nel sistema circolatorio. La bile gioca un ruolo importante nel detossificare le endotossine per la loro azione detergente nel lume intestinale. Proteine specifiche del plasma sono in grado di legare le endotossine, come la amyloide A che appartiene alle proteine della fase acuta di infiammazione; questo legame può essere dietro il processo di detossificazione e inattivazione. Il fegato produce la proteina legante il LPS (LPB) che viene rilasciata nel siero: la coniugazione di LPS ed LPB permette una miglior diffusione ed i recettori cellulari specifici CD14 di riconoscere e innescare la reazione delle citochine. Dopo il rilevamento delle endotossine da parte degli epatociti e delle cellule di Kupfer, forme attive ed inattive di endotossine possono essere trasferite alla bile ed escrete nel lume intestinale. Approssimativamente il 7% delle endotossine assorbite sono escrete attraverso la bile.
Le endotossine sono anche in grado di compromettere l’efficienza alimentare. Uno studio recente sulle sfide abituali negli allevamenti suini ha evidenziato un potenziale di riduzione del consumo di mangime del 3% nel caso di infestazione parassitaria, del 4,1% da condizioni di alloggiamento mediocri; del 25,2% nel caso di micotossicosi (malattia indotta da micotossine) e del 26,8% nel caso di intossicazione da endotossine.
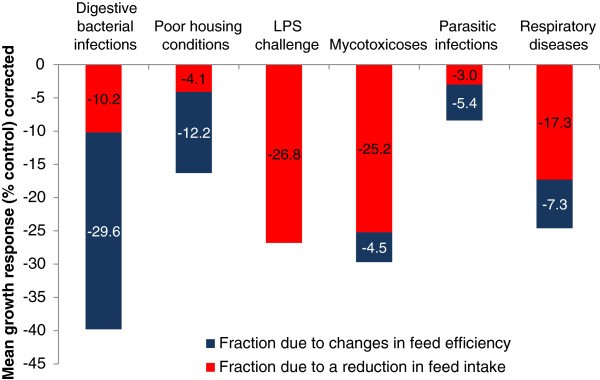
Figura 4. Impatto di sfide abituali sull'efficienza e sul consumo di mangimi (fonte: Goodband et al., 2014).



