La comparsa di nuovi ceppi del virus PRRS insieme alle limitazioni dell'uso di antibiotici stanno cambiando i paradigmi nella produzione suina. È un dato di fatto che, in Spagna a livello globale, le perdite di suini tra le fasi di svezzamento ed ingrasso sono aumentate del 4%, a causa di un aumento dei problemi sanitari. Ogni giorno conosciamo più strumenti per il controllo di molte delle patologie che affliggono gli allevamenti, ma dobbiamo attuare un approccio diverso ai soliti problemi e questo è il lavoro del Veterinario di Produzione: saper cambiare... Per fare questo, dobbiamo fare affidamento sia su nuove ricerche (libri, articoli scientifici, ecc.) sia sui suini stessi.
Attualmente, è ben documentato che il microbiota intestinale influenza chiaramente la modulazione delle risposte infiammatorie e che, quindi, qualsiasi malattia digestiva che porti a cambiamenti nel microbiota può causare una riduzione dei macrofagi alveolari e un cambiamento nella risposta immunitaria Th1 e Th2 (Leucociti T Helper). Di conseguenza si può avere un aumento della risposta infiammatoria a livello polmonare e anche un aumento delle recidive e della persistenza delle malattie polmonari.

Caso clinico
Incontriamo un allevamento con circa 2000 scrofe situato nella regione di Murcia. Si tratta di un'azienda agricola-zootecnica che ha un'estensione di circa 100 ettari: le diverse fasi di produzione sono molto distanti tra loro. Le scrofe sono in un nucleo, gli svezzamenti si trovano a 1 km di distanza e gli ingrassi sono distribuiti a circa 3 km dalle scrofe.
L'allevamento è positivo al virus PRRS e attualmente stabile. Dispone di un Piano di Monitoraggio mensile con campionamento delle lingue dei nati morti, differenziando tra pluripare e primipare. Tale monitoraggio consiste nella determinazione della PCR contro PRRS e PCV-2, con l'obiettivo di avere entrambi i virus controllati in allevamento. Durante questo periodo, i test delle lingue dei nati morti sono risultati negativi per PRRS e PCV-2. Quando un campione risulta positivo al virus PRRS, eseguiamo il sequenziamento ORF5 per verificare se si tratta di un nuovo ceppo da ingresso laterale del virus e quindi se ci sono falle nella Biosicurezza Esterna.
L'allevamento è positivo alla Brachyspira hyodysenteriae ma, attraverso l'uso di autovaccini (vaccini stabulogeni), i sintomi sono controllati e non si osservano sintomi né nelle scrofe in produzione né nelle future riproduttrici (scrofette), che hanno detto autovaccino incluso nel loro Programma di Vaccinazione. Questo processo è considerato controllato, anche se i sintomi compatibili con la Dissenteria Suina ("Diarrea Rossa") compaiono occasionalmente in ingrasso quando pesano circa 50-80 kg, coincidendo con una perdita di immunità acquisita attraverso le scrofe.
Nell'ingrasso si osserva un certo grado di morsicatura delle code che per noi è un indicatore della presenza di Dissenteria anche nei casi in cui non vediamo una clinica chiaramente compatibile. Se i suini hanno la malattia in forma subclinica e, quindi, un'infiammazione del colon, tendono ad essere più nervosi ed a scodinzolare la coda con insistenza. Come sappiamo, questo è un magnete per i compagni che inizieranno a mordersi a vicenda. Una volta stabilito un comportamento anormale, è difficile da controllare, poiché l'infiammazione cronica induce un comportamento simile all'ansia.

Inizio del problema
I suini vengono trasferiti negli ingrassi di 6.000 posti che vengono riempiti per 4 settimane consecutive. Un mese dopo l'ingresso dei suini, inizia un processo respiratorio con grave dispnea e anoressia. Si decide di somministrare un trattamento antibiotico con florfenicolo solubile nell'acqua di bevanda (il 1° giorno associato ad un antinfiammatorio per aumentare il consumo di acqua), ma dopo il trattamento attuato le perdite continuano e non vi è alcun miglioramento nei suini. I polmoni dei suini morti che mostrano ampie aree di consolidamento polmonare, vengono inviati al Laboratorio. Si decide di somministrare a tutti i suini un trattamento antibiotico iniettabile di Marbofloxacina (da un lato, per essere sicuri che ogni suino riceva la dose appropriata e dall'altro, per poter raggiungere i polmoni con un'efficace concentrazione di antibiotico). Nonostante si noti un miglioramento delle condizioni generali dei suini, dopo due settimane si osserva una ricaduta e continuiamo a non essere in grado di controllare le perdite che si verificano. La clinica ritorna con la stessa intensità e continua a generare un gran numero di morti (Foto 2 e 3).


Quadro 1. Analisi dei campioni polmonari e fluidi orali prelevati nell'ingrasso.
| Data | Ingrasso | Campione | PRRSv | PCV-2 | Influenza tipo A |
|---|---|---|---|---|---|
| Nov-22 | A | Polmone | PRRSv (Ct 28) | - | - |
| Nov-22 | B | Polmone | PRSSv (Ct 20) | - | - |
| Nov-22 | C | Fluidi orali | PRRSv (Ct 30) | - | - |
| Nov-22 | D | Fluidi orali | PRRSv (Ct 36) | - | - |
Anche se è sorta una domanda molto importante: il normale è che un patogeno di nuova introduzione, se ha una bassa prevalenza, produca sintomi alla fine del periodo di ingrasso e all'aumentare della sua prevalenza lo faccia in suini sempre più giovani. Tuttavia, questo non è quello che è successo in questo allevamento, quindi abbiamo pensato che i trattamenti antibiotici avrebbero ridotto l'impatto della malattia, ma non è quello che è successo.
Quando è stato ottenuto il sequenziamento del virus PRRS, è stato verificato che si trattava dello stesso ceppo in quanto vi era un'omologia filogenetica con il ceppo residente di quella piramide. Tuttavia, in fase d'ingrasso non si era mai comportato in questo modo. In precedenza, i sintomi respiratori apparivano, ma erano facilmente controllati con un trattamento antibiotico (florfenicolo).
Cosa stava succedendo nell'ingrasso per questo comportamento anomalo?
In questo momento si sta valutando un nuovo modo di affrontare l'infezione, visto che ogni giorno c'è una maggiore conoscenza dell'Asse Intestino-Polmone, ed è noto che ciò che accade nell'intestino influisce sulla gravità dei processi respiratori.
Si è valutato se ci fosse qualche altra patologia che non fosse polmonare, ma localizzata nell'intestino e abbiamo isolato Brachyspira hyodesenteriae nelle feci. Questo reperto non era nuovo, ma ritenevamo fosse sotto controllo, dal momento che non comparivano i classici sintomi della diarrea muco-emorragica, ma solo si notava qualche muco che apparentemente non sembrava avere molta rilevanza clinica.
La presenza di Brachyspira hyodesenteriae potrebbe essere una delle cause della gravità e della persistenza dei sintomi clinici?
IPOTESI: “La presenza di Brachyspira hyodesenteriae ed il suo impatto sul microbiota intestinale potrebbe influenzare la modulazione delle risposte infiammatorie con un aumento della risposta infiammatoria a livello polmonare, ed una riduzione dei macrofagi alveolari, che creerebbe un ambiente immunitario in cui non sarebbe possibile eliminare il virus della PRRS con sufficiente efficacia e favorirebbe anche un aumento delle recidive e della persistenza delle malattie polmonari”.
È stato verificato che il ceppo di Brachyspira hyodesenteriae isolato era ancora il ceppo residente e riscontrata le MIC per i diversi antibiotici che dovevamo usare per il suo controllo.
Quadro 2. MIC dei diversi antibiotici per il ceppo di Brachyspira hyodesenteriae isolato.
| CEPA SV22-3448 | |||||
|---|---|---|---|---|---|
| Antibiotico range analizzato (μg/ml) |
CMI (μg/ml) |
Interpretazione sensibilità | Range (μg/ml) | ||
| Tiamulina (0,063 - 8) | 0,5 | Intermedia |
≤ 0,25 > 0,25 - ≤ 2 > 2 |
Sensibile Intermedia Resistente |
La et al., 2016 |
| Valnemulina (0,031 - 4) | < 0,031 | Sensibile |
≤ 0,25 > 0,25 - ≤ 2 > 2 |
Sensibile Intermedia Resistente |
La et al., 2016 |
| Tilvalosina (0,25 - 32) | 8 | Intermedia |
≤ 0,25 - < 1,5 > 1,5 - ≤ 36 > 36 |
Sensibile Intermedia Resistente |
Pringle et al., 2012 |
| Lincomicina (0,5 - 64) | 32 | Intermedia |
≤ 4 > 4 - ≤ 36 > 36 |
Sensibile Intermedia Resistente |
Kirchgässner et al., 2016 |
| Tilosina (2 - 128) | > 128 | Resistente |
≤ 1 > 1 - ≤ 4 > 4 |
Sensibile Intermedia Resistente |
La et al., 2016 |
Come possiamo vedere nel quadro 2, la tiamulina sembrava essere l'opzione migliore, ma a livello di campo e con le caratteristiche fisiche dell'acqua nella regione di Murcia (scarsa qualità e alta salinità), non si ottiene una buona efficacia con questo antibiotico, invece la lincomicina è il principio attivo che ci offre maggiore copertura per una migliore risoluzione del problema clinico. È stato intrapreso un trattamento antibiotico incentrato principalmente sul controllo della Dissenteria Suina a livello subclinico.
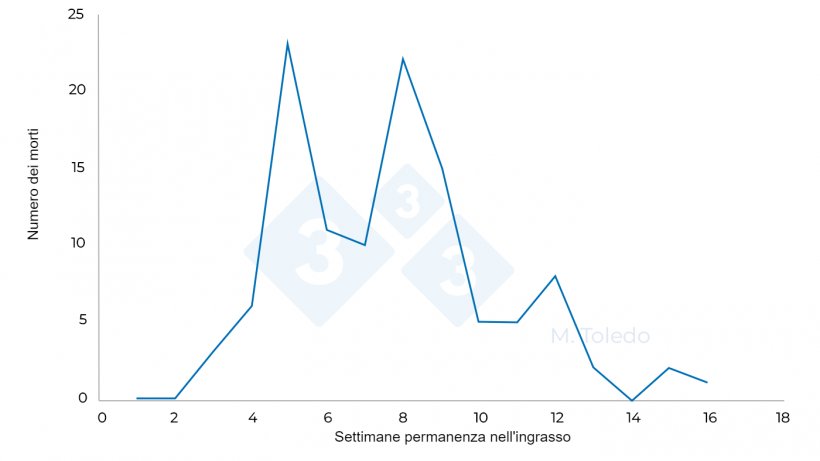
Conclusione
Il successo nell'approccio a questo Caso Clinico è stato nel controllo della Dissenteria, anche se l'abbiamo riscontrata in modo subclinico. In questo modo il processo respiratorio si è espresso in maniera molto meno aggressiva e senza recidive. Il controllo della Dissenteria ha portato anche ad una riduzione del verificarsi di nuovi episodi di morsicatura delle code.
Dobbiamo iniziare a mettere in atto diversi approcci ai processi respiratori (soprattutto quello che ci sta causando più problemi, che è il virus PRRS), monitorando e controllando i sintomi enterici che compaiono a causa delle interazioni tra i diversi patogeni intestinali che sono in grado di produrre disbiosi. È importante non considerare singolarmente questi patogeni digestivi poiché tra loro si stabiliscono molte interazioni. (Brachyspira spp, Lawsonia intracellularis, Escherichia coli, ecc..). Questa alterazione dell'intestino può modulare l'intensità e la durata dei processi respiratori e, quindi, complicarne il controllo.