Test disponibili:
Coltura batterica
- Isolamento di organismi vivi.
- Tipo di campione: feci.
- Pro:
- Relativamente a buon mercato.
- La presenza di Brachyspira spp. fortemente beta-emolitica è associata alla virulenza.
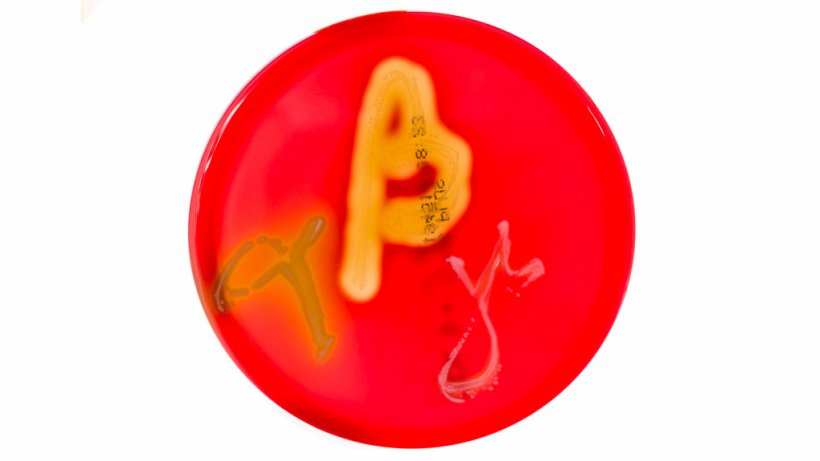

Tabella 1: Relazione tra la beta-emolisi in Brachyspira spp. e la malattia.
| Brachyspira spp. | Beta-emolisi | Malattia |
|---|---|---|
| B. hyodysenteriae | Forte | Lesioni della Dissenteria Suina |
| B. hampsonii | Forte | Lesioni della Dissenteria Suina |
| B. suanatina | Forte | Lesioni della Dissenteria Suina |
| B. pilosicoli | Debole | Coliti da spirochete |
| B. murdochii | Debole | Coliti da spirochete |
| B. intermedia | Debole | Coliti da spirochete |
| B. innocens | Debole | Non patogena |
- Contro:
- Meno sensibile del test PCR.
- Crescita lenta (fino a 10 giorni).
- Richiede coltura anaerobica.
- Alcuni ceppi meno virulenti possono essere trovati negli allevamenti senza segni clinici o lesioni.
Suscettibilità antimicrobica
- Test in vitro: capacità di un organismo vivente di crescere sotto specifiche concentrazioni di diversi antimicrobici.
- Tipo di campione: feci.
- Pro:
- Identificazione della suscettibilità o resistenza di ceppi specifici ai comuni antimicrobici.
- Contro:
- Richiede un isolato batterico.
- I test in vitro possono differire leggermente dai risultati in vivo.
- Alcuni antimicrobici specifici potrebbero non essere inclusi o potrebbero richiedere test speciali separati.
- Costo moderato.
- I risultati richiedono 7 giorni.
Istopatologia
- Valuta la presenza di lesioni tissutali che possono confermare la presenza di malattia.
- Tipo di campione: tessuti.
- Pro:
- Le lesioni istopatologiche possono essere altamente suggestive se si trovano molte spirochete vicino alle lesioni intestinali..
- Può rilevare forme lievi della malattia.
- I tessuti intestinali di un animale morto di recente devono essere fissati in formalina.
- Le lesioni sono simili ad altre malattie.
Impression smear
- Rileva la presenza di batteri.
- Tipi di campioni: tessuto dell'intestino crasso, feci.
- Pro:
- Facile da eseguire.
- Colorazione non specifica.
- Microscopia in campo oscuro.
- Una diagnosi presuntiva può essere fatta rilevando un gran numero di spirochete.

Figura 2. Grafico che mostra la forma spirochete di Brachyspira spp. Fonte: Y_tambe. https://creativecommons.org/licenses/by-sa/3.0/deed.en - È possibile identificare un numero basso, moderato o elevato di batteri presenti.
- Facile da eseguire.
- Contro:
- Richiede la presenza di un numero significativamente maggiore di batteri rispetto alla coltura o alla PCR.
- Non valuta la capacità emolitica degli isolati e quindi non distingue tra ceppi non patogeni, colite da spirochete e dissenteria suina.
Polymerase chain reaction (PCR)
- Rileva la presenza di una specifica sequenza di acido nucleico batterico (DNA).
- Tipi di campioni: tessuto intestinale, tamponi fecali, feci.
- Pro:
- Alta sensibilità.
- La quantificazione mediante PCR è associata alla presenza di lesioni.
- Costo moderato.
- I campioni di feci o di tessuto possono spesso essere raggruppati per ridurre i costi e minimizzare la perdita di sensibilità (soprattutto per quanto riguarda la rilevanza clinica).
- Contro:
- Alta sensibilità: conferma la presenza di batteri ma non della malattia.
- Sono necessari primers adeguati per rilevare e differenziare tra Brachyspira spp.
Enzyme-linked immunosorbent assay (ELISA)
- Rileva la presenza di anticorpi.
- Tipo di campione: siero.
- Pro:
- Può rilevare l'infezione a livello di allevamento.
- Gli anticorpi possono durare per diversi mesi.
- I livelli sierici di IgG sono correlati alla durata dei segni clinici.
- Contro:
- I kit non sono facilmente disponibili.
- Bassa sensibilità e specificità.
- Sono utilizzati per il rilevamento a livello di allevamento e non per la diagnosi dei singoli animali.
- Gli anticorpi specifici e il tempo di rilevamento possono variare leggermente tra i diversi kit commerciali disponibili.
- Spesso, gli antigeni utilizzati possono essere specifici per particolari specie di Brachyspira.
- Non c'è correlazione tra i livelli di anticorpi e la protezione.
- Non è conosciuta la protezione crociata tra Brachyspira spp.
Interpretazione dei risultati:
Coltura batterica
- Positivo: batterio presente.
- Beta-emolisi forte – Dissenteria Suina.
- Beta-emolisi debole – colite da spirochete o non patogena.
- Negativo: Negativo, animale eventualmente precedentemente trattato con antibiotici o troppo tardi nell'infezione.
Suscettibilità antimicrobica
- Sensibile: possibile buona scelta per il trattamento se l'antimicrobico può raggiungere il tessuto bersaglio.
- Resistente: selezionare un antimicrobico diverso.
- MIC: Se viene eseguita la MIC (concentrazione minima inibente), è necessario assicurarsi che l'antimicrobico selezionato raggiunga il valore MIC indicato nell'organo bersaglio.
Istopatologia
- Positivo: Le spirochete trovate vicino alle lesioni sono una diagnosi presuntiva.
- Negativo: nessuna lesione intestinale.
Impression smear
- Quantità di spirochete presenti:
- Alta: altamente indicativo di malattia.
- Moderata: interpretazione variabile.
- Bassa: valore discutibile (potrebbe essere una condizione non patogena o cronica)
- Non presente: animale eventualmente precedentemente trattato con antibiotici o contribuente non significativo.
PCR
- Positivo: conferma la presenza del batterio.
- Negativo: Negativo o infezione troppo vecchia per rilevare il batterio o l'animale precedentemente trattato con antibiotici.
ELISA
- Positivo: Precedenti esposizioni (>2-4 settimane) a vaccini o batteri di campo.
- Negativo:
- Negativo al vaccino o ai batteri di campo.
- Infezione troppo vecchia per essere rilevata.
- L'uso di antibiotici può inibire la crescita batterica e diminuire la risposta immunitaria.
Scenari:
Suini da ingrasso con diarrea (acuta)

- Raccogliere campioni fecali da 10 o più suini con diarrea non trattati con antibiotici e inviarli per coltura batterica e PCR in pool di 5.
- Autopsia di 1-3 suini recentemente morti o soppressione di suini con diarrea. Valutare macroscopicamente l'intestino crasso (in particolare il cieco e il colon a spirale) e fissarlo in formalina per l'istopatologia.
Storia cronica di diagnosi di dissenteria suina ma senza segni clinici osservati
- Raccogli campioni di feci da 4-6 box e invia per la PCR.
- Raccogliere campioni da 15-20 suini a 14 e 18 settimane di età.
- Due approcci alla raccolta:
- Trasversale: raccogliere contemporaneamente da diversi gruppi di età (si ottengono risultati più velocemente).
- Longitudinale – raccogliere dagli stessi suini nel tempo (si ottengono risultati più accurati).
- Analisi di campioni di siero mediante ELISA.
- Due approcci alla raccolta: