Test disponiblili:
Patologia macroscopica

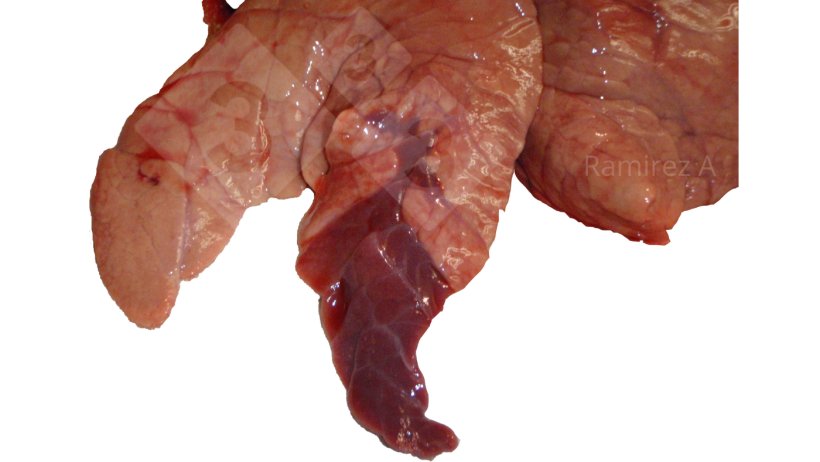
- Ispezione visiva delle lesioni polmonari.
- Pro:
- Facile da fare.
- È possibile valutare le infezioni tardive nei suini inviati al macello.
- Contro:
- Non diagnostico/patognomonico; molte altre possibili cause.
- Richiede un'altra conferma diagnostica.
Coltura batterica
- Isolamento di organismi viventi da tessuti con lesioni o lavaggio bronco-alveolare.
- Tipi di campioni: polmonare o lavaggio bronco-alveolare
- Pro:
- Criterio di riferimento.
- I suini possono risultare positivi per 7-8 mesi (lungo periodo di colonizzazione).
- Contro:
- Richiede un terreno di coltura speciale (terreno Friis).
- Disponibile solo in pochissimi laboratori.
- Caro.
- Molto difficile da coltivare (molti falsi negativi).
Immunoistochimica (IHC)
- Rileva la presenza di antigene batterico.
- Tipo di campione: tessuto polmonare.
- Pro:
- Rileva i batteri nel sito della lesione (buona prova di causalità).
- I suini possono risultare positivi per 7-8 mesi (lungo periodo di colonizzazione).
- Contro:
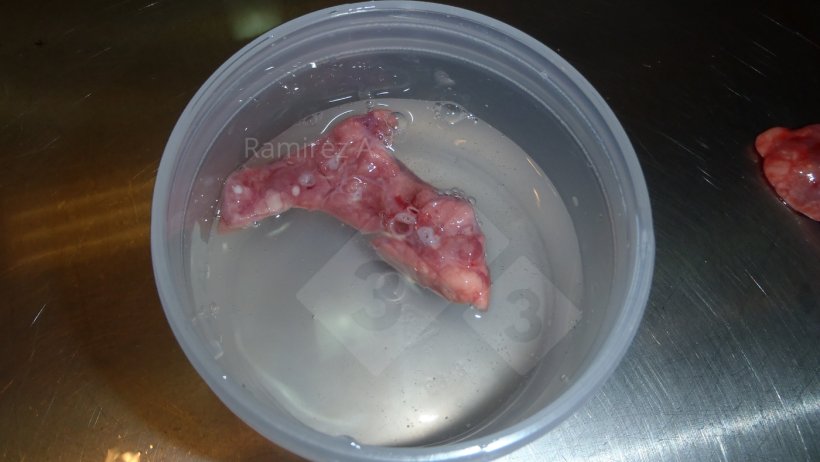
- È necessario inviare il campione di tessuto corretto: il tessuto polmonare deve contenere una sezione trasversale delle vie aeree (cellule epiteliali bronchiali).
- Richiede un numero significativamente maggiore di batteri rispetto alla PCR.
- Valuta solo una piccola quantità di tessuto.
Anticorpi fluorescenti (FA)
- Rileva la presenza di antigene batterico.
- Tipo di campione: tessuto polmonare.
- Pro:
- Rileva il virus nel sito della lesione (buona evidenza di causalità).
- I suini possono risultare positivi per 7-8 mesi (lungo periodo di colonizzazione).
- Contro:
- È necessario inviare il campione di tessuto corretto: il tessuto polmonare deve contenere una sezione trasversale delle vie aeree (cellule epiteliali bronchiali) (Figura 2).
- Richiede un numero significativamente maggiore di batteri rispetto alla PCR.
- Valuta solo una piccola quantità di tessuto.
Reazione a catena della polimerasi (PCR)
- Rileva la presenza di specifiche sequenze di acido nucleico batterico (DNA).
- Tipi di campioni: polmone, tampone (nasale, laringeo, tracheobronchiale o bronchiale) o lavaggio bronco-alveolare.
- Pro:
- Sensibilità molto elevata (può rilevare piccole quantità di batteri)
- È possibile combinare più campioni per aumentare la sensibilità diagnostica quando si effettua una diagnosi in allevamento.
- I suini possono risultare positivi per 7-8 mesi (lungo periodo di colonizzazione).
- Costo moderato.
- Contro:
- Non dimostra la malattia.
- I fluidi orali sono un tipo di campione scadente (molti falsi negativi)
Tabella 1: Riepilogo schematico della ricerca e dei risultati sul campo sulla sensibilità di diversi tipi di campioni per il test PCR di Mycoplasma hyopneumoniae.
| Sensibilità relativa | Pooling* | |
|---|---|---|
| Fluidi orali | - | No |
| Tampone nasale | + | Variabile |
| Tampone laringeo | ++ | Vantaggioso |
| Tampone tracheo-bronchiale | ++ | Vantaggioso |
| Tampone bronchiale | +++ | Vantaggioso |
| Lavaggio bronco-alveolare | ++ | No |
| Tessuto polmonare | ++++ | Sì |
* Il pooling o raggruppare campioni può essere utile per aumentare la sensibilità diagnostica durante l'esecuzione di una diagnosi in allevamento; non da un solo suino.
Saggio di immunoassorbimento enzimatico (ELISA)
- Rileva la presenza di anticorpi.
- Tipo di campione: siero.
- Pro:
- Gli animali rimangono positivi a lungo.
- Può essere utilizzato in casi cronici.
- Contro:
- Gli anticorpi specifici ed i tempi di rilevamento possono variare leggermente tra i vari kit commerciali disponibili.
- Non distingue tra anticorpi materni e di esposizione.
- Il livello di anticorpi non è correlato alla protezione.
- La vaccinazione non induce sieroconversione (altamente dipendente dal vaccino e dal dosaggio utilizzato).
- Molti suini infetti non si sieroconvertono.
- Gli anticorpi non vengono sempre rilevati durante l'intero periodo di infezione.
- Qualche cross-reattività con altri micoplasmi, in particolare M. flocculare, che non è patogeno e si trova comunemente nei suini.
Interpretazione dei risultati:
Patologia macroscopica:
- Positivo: La patologia macroscopica del polmone può fornire una possibile diagnosi.
- Negativo: I primi casi di solito non si presentano con lesioni polmonari estese.
Coltura batterica:
- Positivo: Conferma la malattia.
- Negativo: Negativo, i batteri non vengono rilevati se il test viene eseguito molto tempo dopo l'infezione o con l'uso di antibiotici, o semplicemente non possono crescere a causa della crescita eccessiva di altri batteri (presenti ma molto difficili da coltivare).
IHC:

- Positivo: I batteri sono presenti nel sito della lesione.
- Negativo: Negativo o infezione troppo vecchia per rilevare i batteri o l'animale precedentemente trattato con antibiotici.
FA:
- Positivo: I batteri sono presenti nel sito della lesione.
- Negativo: Negativo o infezione troppo vecchia per rilevare i batteri o l'animale precedentemente trattato con antibiotici.
PCR:
- Positivo: I batteri sono presenti; non conferma la malattia.
- Negativo: Negativo o infezione troppo vecchia per rilevare i batteri o l'animale precedentemente trattato con antibiotici.
ELISA:
- Positivo: Anticorpi materni o precedente esposizione (di solito da 3 a 8 settimane dopo l'esposizione) a vaccini o batteri di campo.
- Negativo: Negativo o infezione che non stimola la sieroconversione o troppo recente per essere rilevata (di solito sono necessarie da 3 a 8 settimane dopo l'esposizione).
Scenari
Suini da ingrasso con tosse cronica:
- Necroscopia 1-3 suini morti di recente o eutanasia di suini con la tosse. Valuta macroscopicamente i polmoni per il consolidamento cranio-ventrale. Raccogliere diversi pezzi di polmone (assicurarsi di includere le vie aeree nel campione) e fissarli in formalina per IHC o FA.
- La percentuale di polmoni con lesioni è direttamente correlata all'impatto economico della malattia.
Confermare che gli animali da rimonta sono negativi al Mycoplasma hyopneumoniae
- Assicurati che non ci siano segni clinici di tosse.
- Raccogliere almeno 30 campioni di siero casuali dalla rimonta e analizzarli mediante ELISA.
Monitorare l'escrezione nella rimonta prima di introdurla in un allevamento di scrofe positive o negative
- Assicurati che non ci siano segni clinici di tosse.
- Raccogliere almeno 30 campioni casuali di tampone laringeo dalla rimonta. Mescolare (pool) in gruppi di 5 o 6 e analizzare mediante PCR.