Test disponibili
Reazione a catena della polimerasi (PCR Polymerase Chain Reaction)

- Rileva la presenza di specifiche sequenze di acido nucleico virale (RNA).
- Tipi di campioni: siero o tessuti.
- Pro:
- Metodo più sensibile e preferito per rilevare l'agente.
- I campioni possono spesso essere raggruppati in pool per ridurre i costi e ridurre al minimo la perdita di sensibilità.
- Contro:
- Costo moderato.
- Richiede primers adeguati.
Anticorpi fluorescenti (FAT Fluorescent Antibody Test )
- Rileva la presenza di virus.
- Tipi di campioni: tessuti, in particolare tonsille.
- Pro:
- Buona sensibilità.
- Contro:
- Non distingue tra vaccinazione e infezione da virus di campo.
- I vaccini vivi modificati possono dare un FAT positivo per circa 2 settimane..
- Non fattibile per un gran numero di campioni.
- I risultati dipendono dal ceppo virale utilizzato nel test.
- L'affidabilità dipende molto dall'abilità dei tecnici.
- Non distingue tra vaccinazione e infezione da virus di campo.
Immunoperossidasi differenziale mediante anticorpi monoclonali (MAbs)
- Rileva la presenza dell'agente.
- Tipi di campioni: tonsille o altri organi FAT-positivi.
- Utilizza una serie di tre diversi anticorpi monoclonali (MAb) per distinguere tra vaccinazione, infezione da virus di campo e altri Pestivirus.
- Pro:
- Consente di distinguere tra vaccinazione, infezione da virus di campo e altri Pestivirus.
- Contro:
- Costo medio-alto.
- Richiede un campione di tessuto FAT positivo.
- I risultati dipendono dai tre diversi MAb e da un anticorpo policlonale (PAbs) utilizzati nel test.
- MAbs che riconoscono tutti i ceppi virali della PSC.
- MAbs che riconosce tutti i ceppi vaccinali per la PSC usata in questo paese.
- MAbs che riconosce virus della diarrea bovina (BVD) e della malattia della frontiera o di Border (BD).
- PAbs che riconosce la PSC.
- Non fattibile per un gran numero di campioni.
- L'affidabilità dipende molto dall'abilità dei tecnici.
Saggio di immunoassorbimento enzimatico (ELISA Enzyme-Linked Immunosorbent Assay)
- Rileva la presenza di anticorpi.
- Tipi di campioni: siero.
- Pro:
- Gli animali rimangono positivi per diverse settimane.
- Può essere utilizzato nei casi cronici.
- Può essere utilizzato per differenziare l'esposizione al virus di campo dal vaccino con geni deleti.
- Qualsiasi risultato positivo per il virus di campo è considerato significativo.
- Contro:
- Se possibile, il test appropriato deve essere abbinato alla delezione genica appropriata nel vaccino (di solito E2).
- Gli animali impiegano almeno 21 giorni per diventare sieropositivi.
- Può verificarsi reattività crociata con altri Pestivirus.
Neutralizzazione virale (VN Virus neutralization)
- Rileva la presenza di anticorpi.
- Tipi di campioni: siero.
- Pro:
- Gli animali rimangono positivi per diverse settimane.
- Può essere utilizzato nei casi cronici.
- Sensibilità maggiore rispetto ad ELISA (può rilevare una concentrazione inferiore di anticorpi).
- Contro:
- Non fattibile per un gran numero di campioni.
- Gli animali impiegano almeno 21 giorni per diventare sieropositivi.
- Non distingue tra vaccinazione e infezione da virus di campo.
- L'affidabilità dipende molto dall'abilità dei tecnici.
- La reattività dipende dal ceppo virale utilizzato.
- Può verificarsi reattività crociata con altri Pestivirus.
Interpretazione dei risultati:
PCR
- Positivo: è presente un virus di campo o un ceppo vaccinale.
- Negativo: Negativo o il virus non viene rilevato se il test viene eseguito molto tempo dopo l'infezione.
FAT
- Positivo: È presente virus di campo o ceppo vaccinale.
- Negativo: Negativo o il virus non viene rilevato se il test viene eseguito molto tempo dopo l'infezione.
Immunoperossidasi con MAbs
- Positivo: Vedere tabella 1.
- Negativo: Negativo o il virus non viene rilevato se il test viene eseguito molto tempo dopo l'infezione.
Tabella 1. Interpretazione dei risultati del test dell'immunoperossidasi differenziale con anticorpi monoclonali (MAbs). Fonte: OIE.
| Anticorpo policlonale | Anticorpo monoclonale specífico per | Interpretazione | ||
|---|---|---|---|---|
| Ceppo PSC | Ceppo vaccinale PSC | Ceppo BVD/BD | ||
| + | + | — | — | ceppo di campo della PSC |
| + | + | + | — | ceppo vaccinale della PSC |
| + | — | — | + | ceppo di BVD/BV |
| + | — | — | — | Altri virus no PSC Pestivirus* |
* Sempre si deve tenere in considerazione dell'esistenza di nuovi ceppi di PSC e qualsiasi ceppo isolato di casi sospetti di PSC devono essere inviati ad un Laboratorio di referenza dell'OIE.
ELISA
- Positivo: anticorpi materni o precedente esposizione (>21 giorni) al vaccino o al virus di campo.
- Negativo: negativo o esposizione al vaccino o al virus di campo troppo recente per essere rilevata.
La tabella 2 aiuta a dimostrare le capacità DIVA (differenziazione degli animali infetti dagli animali vaccinati) di alcuni test ELISA quando viene utilizzato un vaccino con geni deleti.
| ELISA non differenziale | Risultato ELISA-E2 | Interpretazione |
|---|---|---|
| Positivo | Positivo | Animale esposto a virus di campo |
| Positivo | Negativo | Animale vaccinato non esposto a virus di campo |
| Negativo | Positivo | Errore del test, questo risultato non possibile |
| Negativo | Negativo | Animale non vaccinato e non esposto a virus di campo |
VN

- Positivo: Anticorpi materni o precedente esposizione (>21 giorni) al vaccino o al virus di campo.
- Negativo: Negativo o esposizione al vaccino o al virus di campo troppo recente per essere rilevata.
Scenari
È importante notare che alcuni paesi potrebbero richiedere l'approvazione dell'autorità competente prima di poter eseguire qualsiasi test della PSC.
Sospetto di focolaio acuto di PSC in suini di qualsiasi età e allevamenti non vaccinati contro la PSC.
- Raccogliere il sangue da vari animali colpiti e analizzarlo mediante PCR; può essere preso in considerazione il raggruppamento di campioni.
- Raccogliere milze e tonsille da suini morti e analizzarle mediante PCR; può essere preso in considerazione il raggruppamento di campioni.
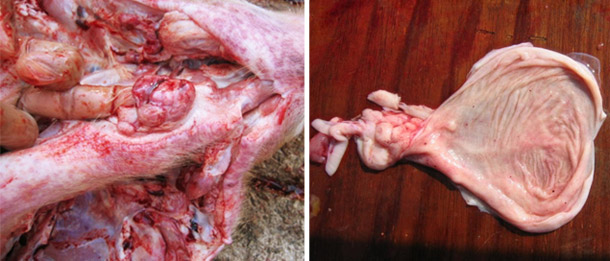
Sospetto di focolaio acuto di PSC in suini di qualsiasi età e allevamenti vaccinati contro la PSC.
- Raccogliere sangue da diversi animali colpiti che non sono stati vaccinati contro la PSC nelle ultime 2 settimane e analizzarlo mediante PCR; può essere preso in considerazione il raggruppamento di campioni.
- Raccogliere milze e tonsille di suini morti e analizzarli mediante PCR; può essere preso in considerazione il raggruppamento di campioni.
- Se la PCR è positiva, testare il campione di tessuto utilizzando FAT e immunoperossidasi con MAbs.
Sospetto di circolazione cronica di PSC in suini di qualsiasi età senza mortalità ed allevamenti non vaccinati contro la PSC
- Raccogliere sangue da 30 suini con segni clinici (campionamento mirato) o selezionati casualmente (nessun segno clinico) e analizzare mediante PCR (può essere considerato il pooling) e individualmente mediante ELISA non differenziale.
Sospetto di circolazione cronica di PSC in suini di qualsiasi età senza mortalità ed allevamenti vaccinati contro la PSC
- Prelevare il sangue di 30 suini (non vaccinati nelle ultime 2 settimane) con segni clinici (campionamento mirato) o selezionati casualmente (nessun segno clinico) e analizzarli mediante PCR (può essere considerato il pooling) e individualmente mediante ELISA non differenziale ed ELISA differenziale E2.