Test disponibili:
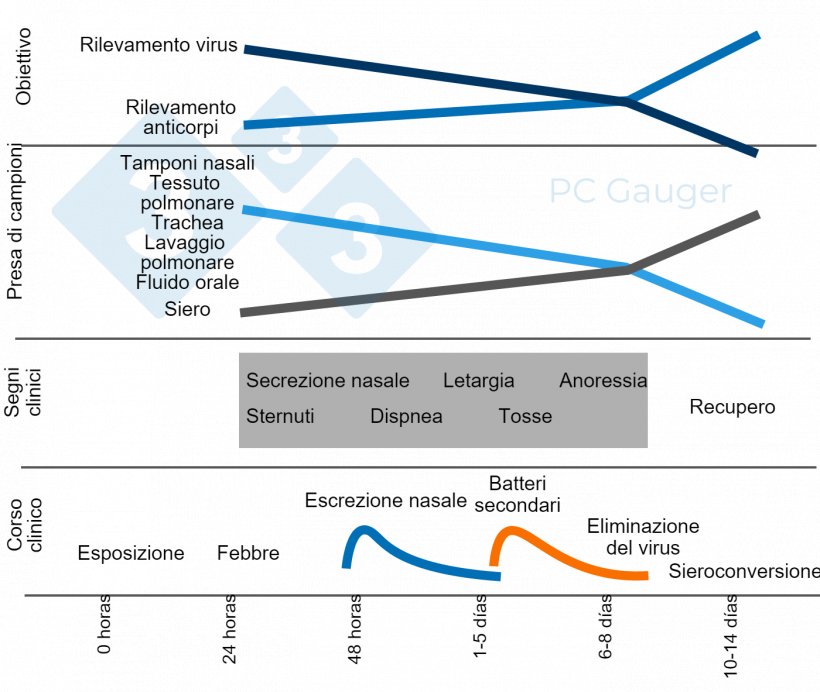
Potrebbe essere utile rivedere l'eccellente sintesi fornita nell'Articolo sull'Influenza di Phil Gauger:
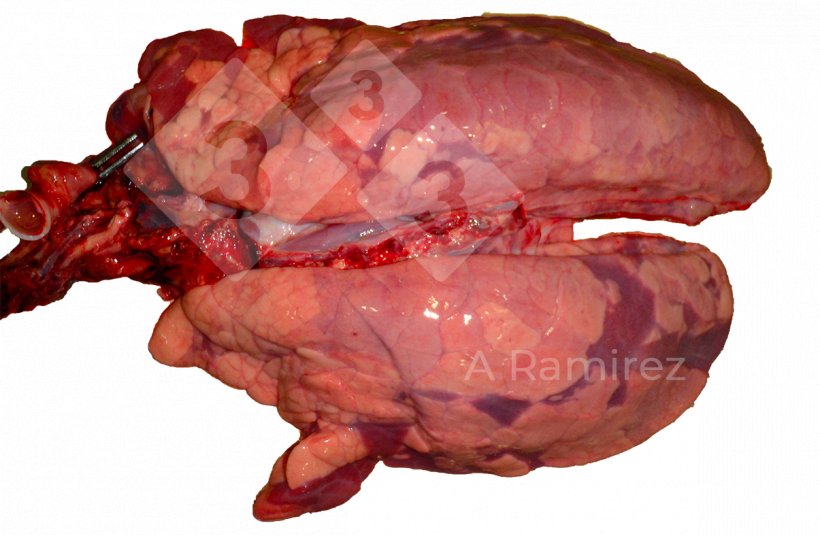
Patologia macroscopica

- Valuta la presenza di lesioni tissutali che possono suggerire la presenza di malattia.
- Ubicazione delle lesioni:
- Consolidamento cranio-ventrale (specialmente nei lobi apicali e cardiaci)
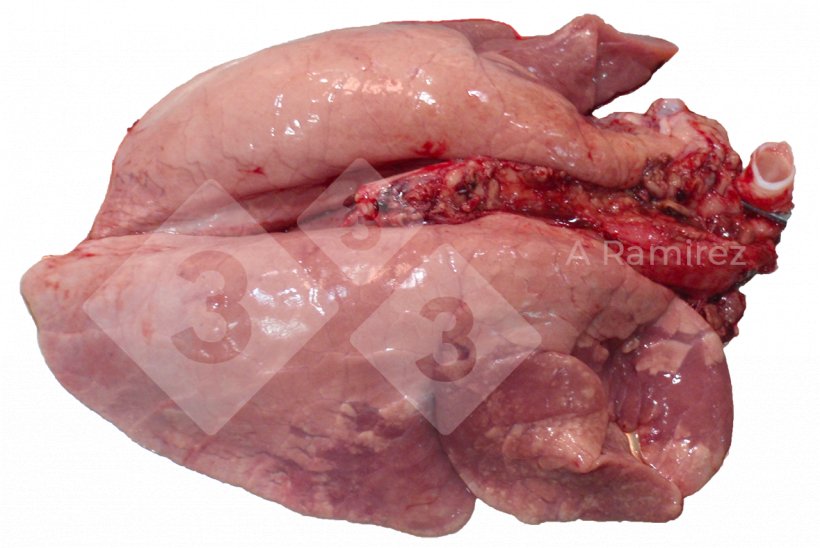
- La presentazione può essere diffusa coprendo più aree del polmone.
- Potrebbe esserci edema inter-lobulare.
- Pro:
- La gravità delle lesioni può essere correlata all'importanza clinica
- Contro:
- Lesioni macroscopiche non diagnostiche (molto simili a Mycoplasma hyopneumoniae)
- Ci sono spesso infezioni secondarie o co-infezioni
Istopatologia
- Valutata la presenza di lesioni che possono confermare la presenza della malattia.
- Tipo di campione: tessuto polmonare.
- Pro:
- La bronchiolite necrotizzante è spesso considerata patognomonica dell'infezione da virus dell'influenza A nei suini.

Figura 4: Istopatologia polmonare che mostra l'assottigliamento dell'epitelio bronchiolare, che è un esempio di necrosi. (Fonte foto: Phil Gauger ISUVDL)
- Le lesioni caratteristiche compaiono pochi giorni dopo la diffusione del virus nei suini, specialmente in presenza di co-infezioni.
- La bronchiolite necrotizzante è spesso considerata patognomonica dell'infezione da virus dell'influenza A nei suini.
- Contro:
- Valuta solo una piccola quantità di tessuto
- Le lesioni non complicate possono risolversi rapidamente (5-7 giorni)
Immunoistochimica (IHC)
- Rileva la presenza di antigene virale.
- Tipo di campione: tessuto polmonare.
- Pro:
- Rileva il virus nel sito della lesione (buona prova di causalità)
- L'antigene bersaglio è solitamente una nucleoproteina che è conservata in tutti i virus dell'influenza A.
- Contro:
- Valuta solo una piccola quantità di tessuto.
- Il virus è presente solo per un breve periodo di tempo (pochi giorni)
- Richiede una quantità significativamente maggiore di virus rispetto alla PCR
Isolamento del virus
- Isola il virus vivo.
- Tipi di campioni: tessuto polmonare, lavaggio broncoalveolare, tamponi nasali.
- Pro:
- Gold Standard.
- Isolamento del virus per l'uso nello sviluppo di vaccini (vaccini stabulogeni-autogenous vaccines) o test sierologici (inibizione dell'emoagglutinazione) per determinare la protezione crociata
- Contro:
- Caro
- Risultati lenti
- Richiede uova di pollo embrionate o cellule di rene canino Madin-Darby (MDCK).
- Il processo di inoculazione è molto laborioso
- Spesso difficile da coltivare (molti falsi negativi)
- La manipolazione dei campioni dal campo al laboratorio può influire sulla sopravvivenza del virus
Polymerase chain reaction (PCR)
- Rileva la presenza di una specifica sequenza di acido nucleico virale (RNA).
- Tipi di campioni: tamponi nasali, fluidi orali, tessuto polmonare, lavaggio bronco-alveolare.
- Pro:
- I primers possono essere progettati per:
- Rilevamento di tutti i sottotipi di virus dell'influenza A, mirati alla nucleoproteina conservata
- Rilevamento di gruppi di virus di sottotipi specifici: sottotipo H1, H3, N1 o N2
- Alta sensibilità
- Rilevamento precoce
- La quantificazione mediante PCR è associata alla presenza di lesioni
- Costo moderato
- I campioni di tamponi o di tessuto possono spesso essere combinati per ridurre i costi e minimizzare la perdita di sensibilità (soprattutto per quanto riguarda la rilevanza clinica)
- I primers possono essere progettati per:
- Contro:
- Elevata sensibilità - soprattutto nei fluidi orali può rilevare la presenza di piccole quantità di virus nell'allevamento, rendendo difficile l'interpretazione clinica dei risultati rispetto all'estensione o alla gravità della malattia.
- Il virus è presente nell'ospite solo per pochi giorni (3-5 giorni soprattutto nei tamponi nasali).
- I campioni di sangue o siero non possono essere utilizzati per il test PCR, poiché il virus rimane nel polmone e non è sistemico.
Sequenziamento genetico
- Sequenza dei segmenti genetici dell'acido nucleico (RNA) del virus.
- Tipi di campioni: tessuto polmonare, tamponi nasali, lavaggio bronco-alveolare, fluidi orali.
- Pro:
- Consente la differenziazione tra sottotipi a molti diversi livelli di cladi
- H1: è suddiviso in cladi che solitamente vengono denominati con l'alfabeto greco (alfa, beta, gamma, ecc.)
- H3: è suddiviso in clusters che solitamente vengono denominati con numeri romani (I, IV, ecc.)
- Molti di questi cladi o cluster rilevanti si Descrivono QUI.
- Può aiutare a differenziare l'introduzione di nuovi virus dai virus esistenti o passati.
- Può aiutare a selezionare i ceppi vaccinali in base al sottotipo/clade
- Consente la differenziazione tra sottotipi a molti diversi livelli di cladi
- Contro:
- Caro
- Di solito viene sequenziato solo il gene HA
- La variabilità tra sottotipi/cladi continua a crescere e sta diventando più complessa
Enzyme-linked immunosorbent assay (ELISA)
- Rileva la presenza di anticorpi.
- Tipo di campione: siero.
- Pro:
- I test ELISA possono essere elaborati per:
- Rilevamento di anticorpi di tutti i sottotipi - diretto alla nucleoproteina conservata
- Rilevazione di anticorpi specifici per sottotipo - diretti alle proteine specifiche emoagglutinina (indicate come H o HA) e/o neuraminidasi (indicate come N o NA)
- Gli animali rimangono positivi per diverse settimane (iniziano a diminuire dopo 8-10 settimane)
- Può essere utilizzato nei casi cronici
- I test ELISA possono essere elaborati per:
- Contro:
- Gli anticorpi specifici e il tempo di rilevamento possono variare leggermente tra i diversi kit commerciali disponibili.
- Gli animali impiegano 10-14 giorni per diventare sieropositivi
- Non distingue tra vaccinazione e infezione da virus di campo
- Non identifica un sottotipo specifico di virus
Hemagglutination Inhibition (HI)
- Rileva la presenza di anticorpi.
- Tipo di campione: siero.
- Pro:
- Gli animali rimangono positivi per diverse settimane
- Può essere utilizzato nei casi cronici
- Può essere utilizzato per determinare il momento appropriato per la vaccinazione evitando l'interferenza degli anticorpi materni.
- Può essere utilizzato per determinare la protezione crociata tra i ceppi
- Contro:
- Ogni test è ceppo specifico
- Richiede l'isolamento del ceppo specifico per valutare la protezione crociata
- Gli animali impiegano 10-14 giorni per diventare sieropositivi
- Non distingue tra vaccinazione e infezione da virus di campo
Interpretazione dei risultati:
Patologia macroscopica
- Positivo: Conferma della presenza di polmonite.
- Negativo: I primi casi possono non manifestare estese lesioni polmonari.
Istopatologia
- Positivo: Conferma della malattia.
- Negativo: Negativi o le lesioni non vengono rilevate se viene testato il campione sbagliato o eseguito molto tempo dopo l'infezione.
IHC
- Positivo: Il virus è presente nel sito della lesione.
- Negativo: Negativo o il virus non viene rilevato se il test viene eseguito molto tempo dopo l'infezione o la concentrazione del virus è troppo bassa (è presente solo per un breve periodo di tempo).
Isolamento del virus

- Positivo: Conferma della malattia.
- Negativo: Il virus non viene rilevato se il test viene eseguito molto tempo dopo l'infezione o semplicemente non può crescere a causa di altra contaminazione o una cattiva manipolazione (presente ma molto difficile da coltivare).
PCR
- Positivo: Conferma della malattia.
- Negativo: Negativo, il virus non viene rilevato se il test viene eseguito molto tempo dopo l'infezione o a causa di un'errata selezione o manipolazione del campione.
- Inconcludente: virus presente molto poco o coinfezione con più di un sottotipo.
Sequenziamento genetico
- Permette di identificare il sottotipo e il clade del virus.
- Consente di regolare il ceppo vaccinale per una migliore protezione.
ELISA
- Positivo: Anticorpi materni o precedente esposizione (> 2 settimane) al vaccino o al virus di campo.
- Negativo:
- Negativo al vaccino o al virus di campo
- Infezione troppo recente per essere rilevata (10-14 giorni alla sieroconversione)
- Incompatibilità tra test e virus (sottotipo o clade)
HI
- Positivo: Anticorpi materni o precedente esposizione (> 2 settimane) al vaccino o al virus di campo.
- Negativo:
- Negativo al vaccino o al virus di campo
- Infezione troppo recente per essere rilevata (10-14 giorni alla sieroconversione)
- Incompatibilità (sottotipo o clade) tra il virus utilizzato nel test e il virus che infetta il suino
In pratica:
Suini da ingrasso con starnuti e sintomi respiratori (acuti o cronici):
- Raccogliere 2-4 campioni di fluido orale dal gruppo e analizzarli mediante PCR.
- Raccogliere 12 tamponi nasali da suini infetti con segni clinici (hanno secrezione nasale chiara), creare 3 pool di 4 campioni ciascuno e analizzarli mediante PCR.
- Sequenziare un campione PCR positivo per determinare meglio il cluster/clade.
Determinazione del tempo di esposizione ed eventuale necessità di vaccinazione:
- Raccogliere campioni da 10-15 suini a 3, 6, 9 e 12 settimane di età.
- Due approcci per la raccolta:
- Trasversale: raccoglie contemporaneamente da diversi gruppi di età (ottiene risultati più velocemente).
- Longitudinale – raccogliere dagli stessi suini nel tempo (si ottengono risultati più accurati).
- Analisi di campioni di siero mediante ELISA.
- Raccogliere 2-4 campioni di fluido orale dal gruppo e analizzarli mediante PCR.
- Sequenza di un campione positivo alla PCR da ciascun gruppo di età per determinare ulteriormente il cluster/clade.