Introduzione
Si tratta di un allevamento commerciale di 350 scrofe a ciclo chiuso in Irlanda del Nord.

L'allevamento è negativo a polmonite enzootica (Mycoplasma hyopenumoniae), pleuropolmonite suina (Actinobacillus pleuropneumoniae), Influenza suina e PRRS.
La tabella 1 illustra il protocollo vaccinale:
Tabella 1. Programma vaccinale.
| Vaccino | Scrofette | Scrofe | Verri | Suinetti |
|---|---|---|---|---|
| Parvovirus + Mal rosso + Leptospirosi | 2 ml iniettati alla selezione e 2 settimane prima della copertura | Iniezione di 2 ml 2 settimane prima della copertura | Iniezione di 2 ml due volte l'anno | |
| Vaccino stabulogeno (Streptococcus suis e Staphylococcus hyicus) | 2 ml ai giorni 65 e 95 dopo la copertura | 2 ml il giorno 95 dopo la copertura |
La rimonta è interna. Si usano verri per la ricerca calore. Le scrofette e le scrofe vengono coperte con inseminazione artificiale con seme proveniente da un unico fornitore.
L'allevamento più vicino è a circa 6 km di distanza.
Storico
L'allevatore ha contattato il veterinario a causa di problemi respiratori e mortalità in ingrasso negli ultimi 3 giorni.
Indagini
3.1. Valutazione clinica
Durante una visita in allevamento a novembre 2017, c'erano molti suini di 18 - 24 settimane con segni clinici di tosse (foto 1 e video 1) e cianosi nelle estremità del corpo. La mangiatoia con mangime a bagnato non era pulito, in che indicava mancanza di appetito. Si misurò la temperatura rettale di vari suini clinicamente sintomatici e si evidenziò febbre. La condizione corporale dei suini era normale.

Video 1. Suini clinicamente malati, con tosse.
Si realizzò una seconda visita dopo 2 settimane per prelevare dei campioni di sangue delle scrofe e dei suini da ingrasso.
Prima dell'episodio, la mortalità dallo svezzamento alla fine dell'ingrasso era del 3,5%, principalmente a causa di suini abbattuti in modo emergenziale per ernie e/o prolassi.
3.2. Analisi di laboratorio
A novembre 2017 sono stati sacrificati 3 suini in allevamento (figura 2).
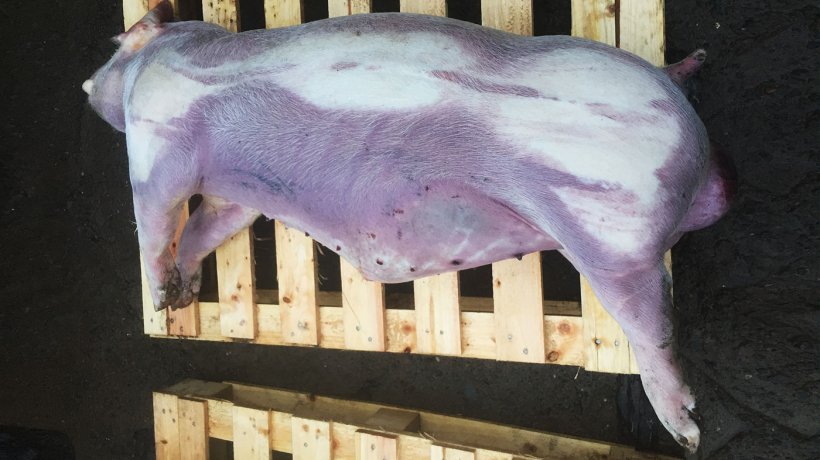
I 3 suini presentavano petecchie emorragiche multiple sul parenchima polmonare (figura 3). Sono stati raccolti campioni che furono inviati al laboratorio.
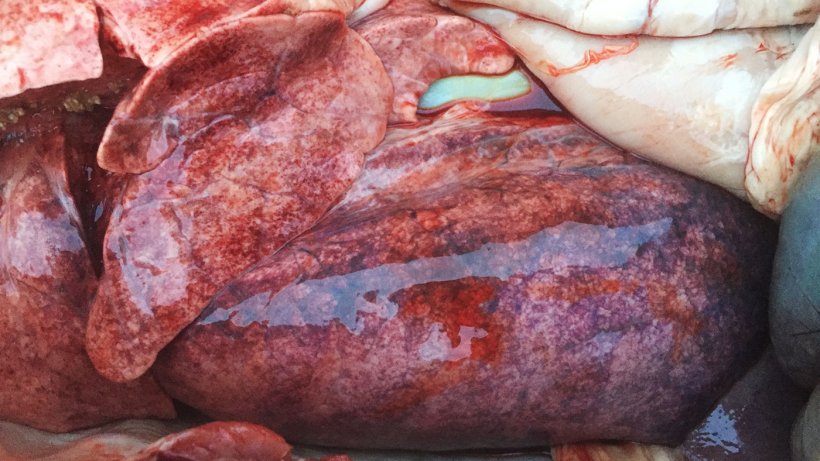
La tabella 2 riassume quanto emerso dai campioni polmonari.
Tabella 2. Risultati di laboratorio dei 3 polmoni inviati.
| Riscontri microbiologici | Riscontri biomolecolari | |
|---|---|---|
| Polmone 1 | Nessuna crescita. | Negativo a Mycoplasma hyopneumoniae e PRRS in RT-PCR. Positivo al virus dell'Influenza tipo A in RT-PCR (CT:18.1) subtipo H1N1. |
| Polmone 2 | Nessuna crescita. | Negativo a Mycoplasma hyopneumoniae e PRRS in RT-PCR. Positivo al virus dell'Influenza tipo A in RT-PCR (CT:26.9) subtipo H1N1. |
| Polmone 3 | Nessuna crescita. | Negativo a Mycoplasma hyopneumoniae e PRRS in RT-PCR. Positivo al virus dell'Influenza tipo A in RT-PCR (CT:31.5) subtipo H1N1. |
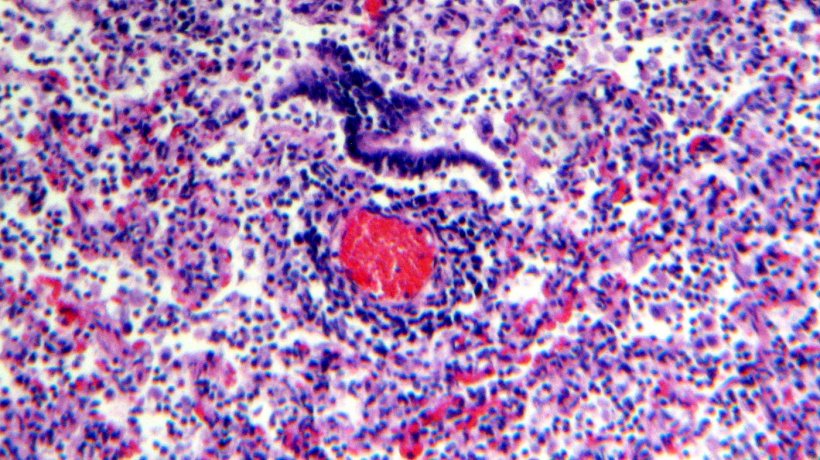
L'esame istologico del tessuto polmonare ha mostrato infiltrazione linfocitica della lamina propria e della submucosa dei bronchi (figure 4 e 5).

La tabella 3 riassume le analisi di laboratorio dei 14 campioni di sangue delle scrofe e dei suini in ingrasso.
| PRRS (ELISA) | Influenza A (ELISA) | Actinobacillus pleuropneumoniae (ELISA) | PCV-2 (ELISA) | Mycoplasma hyopneumoniae (ELISA) | |
|---|---|---|---|---|---|
| 3 suini di 12 settimane con sintomi respiratori | 3 (-) | 2 (+) 1 (-) |
3 (-) | 3 (-) | 3 (-) |
| 2 suini recuperati | 2 (-) | 1 (+) 1 (-) |
2 (-) | 2 (-) | 2 (-) |
| 2 suinetti di sala parto con tosse figli di scrofe diverse | 2 (-) | 2 (+) | 2 (-) | 2 (-) | 2 (-) |
| 7 scrofe | 7 (-) | 7 (+) | 7 (-) | 7 (-) | 7 (-) |
I campioni positivi all'Influenza A furono ulteriormente testati per i subtipi H1N1, H3N2 e H1N2 e i subtipi pandemici panH1N1 e panH1N2. Sono stati trovati titoli altissimi di anticorpi nei confronti di tutti i subtipi (≥ 320 a 2560) nei suini colpiti, indicando un'infezione recente.
4. Diagnosi differenziale
In base alla ricerche cliniche e di laboratorio, abbiamo preparato un elenco per la diagnosi differenziale:
- PRRS (Sindrome Riproduttiva e Respiratoria Suina).
- Virus Influenza tipo A .
- Polmonite enzootica (Mycoplasma hyopneumoniae).
- Pleuropolmonite suina (Actinobacillus pleuropneumoniae).
In base allo storico ed alla consistenza delle evidenze cliniche e di laboratorio fu diagnosticata l'Influenza tipo A.
5. Programma di controllo
Fu implementato il seguente protocollo di emergenza per l'Influenza:
- Vaccinazione a tappeto di tutte le scrofe : 2 volte ad intervallo di 3 settimane.
- I suini furono vaccinati allo svezzamento con 2 ml di un vaccino commerciale appena si diagnosticò l'infezione.
- Medicazione di tutti i mangimi con 85 ppm di tartrato di tilvalosina (tylvalosin) per tonnellata per 20 giorni per contrastare i patogeni respiratori secondari.
Una volta vaccinato 2 volte il parco riproduttore si segui con:
- Vaccinazione delle scrofette: 2 volte prima della copertura, ad intervallo di 3 settimane.
- Le scrofe furono rivaccinate a 14 giorni prima del parto (una dose).
Per sfortuna, al momento dell'episodio, i vaccini disponibili in commercio non coprivano i subtipi pandemici per panH1N1 e panH1N2. Come precauzione, da settembre 2018 è stato introdotto un vaccino che copre i subtipi pandemici.
6. Risposta al programma di controllo
Ci fu un aumento della mortalità dal 3,5%, a inizio fino ad un 11,5%, all'apice 4 settimane dopo. La mortalità si è ridotta gradualmente fino ai livelli normali 10 settimane dopo l'inizio del caso.
La fertilità calò dal 94% all'86% durante questi 2 mesi. Questo ha avuto riflesso con una riduzione della portata al parto dal 91% all'84% nello stesso periodo. Non ci furono aborti.
7. Discussione
L'influenza suina è una malattia respiratoria acuta, infettiva causata dal virus influenzale tipo A. La malattia si caratterizza inizialmente da tosse, dispnea, febbre e prostrazione, seguito da un rapido recupero. Le lesioni normalmente si sviluppano velocemente sul tratto respiratorio e scompaiono altrettanto velocemente, ma in alcuni casi una polmonite virale grave può portare alla morte (Easterday et al., 1999). Tutti i sintomi clinici furono osservati in questo caso.
L'Influenza suina è causata dal virus Influenza tipo A, della famiglia Orthomyxoviridae. Esiste molta informazione disponibile sulle caratteristiche antigeniche, genetiche, strutturali e biologiche dei virus influenza tipo A (Murphy et al., 1990; Lamb et al., 1996). Le glicoproteine di superficie del virus, emoagglutinina (H) e neuraminidasi (N), sono i principali antigeni induttore di immunità protettiva nell'ospite, pertanto mostrano le maggiori variazioni.
Il controllo portato a termine in Irlanda del Nord tra il 2011 e 2013 ha evidenziato che il principale subtipo isolato nei suini era il H1N1 pandemico, seguito da altri subtipi (H1N1, H3N2) con minore frequenza (Borobia et al., 2015).
Le condizioni meteorologiche erano favorevoli alla diffusione del virus nel momento in cui avvenne l'episodio. Umidità elevata con temperature oscillanti nei 3 mesi precedenti e con periodi di forti venti. E' probabile che l'uomo e gli storni (figura 6) possano avere infettato o suini per contatto diretto o per infezione aerogena in virtù della prossimità con altri allevamenti. Entrambe le possibilità possono essere la causa in questo episodio.

La morbilità dell'Influenza si descrive come elevata (vicina al 100%) (Taylor, 1995; Easterday et al., 1999), come si osservò in questo caso. Taylor (1995) e Easterday et al., (1999) hanno descritto una mortalità inferiore all'1% , salvo quando presenti infezioni secondarie e o i suini siamo molto giovani di età. Sfortunatamente, la mortalità ha superato l'1%, come descritto sopra.
Differenti Autori hanno descritto problemi riproduttivi e problemi al parto ed ai suinetti in casi di Influenza Suina (Taylor, 1995; Muirhead et al., 1997; Easterday et al., 1999; Jackson et al., 2007). In questo caso si osservarono solamente un aumento dei ritorni e riduzione della portata al parto.
L'uso di tartrato di tilvalosina (tylvalosin) nei mangimi si basa su report del Dr. David Brown e di Dr. Amanda Stuart del Dipartimento della patologia dell'Università di Cambridge. L'effetto di questo antibiotico macrolide sulla PRRS riduce il numero di cellule infettate in vitro rispetto ad un altro antibiotico macrolide, la tilosina. La tilvalosina riduce inoltre il numero di cellule infettate da altri virus come quello dell'Influenza dell'uomo e dell'Influenza equina (Brown et al., 2006). E ancora, la tilvalosina (tylvalosin)ha un accumulo intracellulare ed una diffusione superiore rispetto ad altri macrolidi (Stuart et al., 2007).






