Descrizione dell'allevamento
Questo articolo descrive un caso clinico avvenuto nel settore gestazione di un allevamento a ciclo chiuso. La capacità dell'allevamento era di 650 scrofe (ibride commerciali di Large White × Landrace) e avevano un nucleo di 35 GPs per la produzione di F1 per autorimonta. Le scrofe svezzate e le scrofette da rimonta erano alloggiate in gabbie individuali per 30-35 giorni dopo l'inseminazione, realizzata con 2 interventi con seme fresco dello stesso verro. A 30-35 giorni le scrofe venivano spostate in box dove rimanevano in gruppo (10 scrofe per gruppo). Lo schema vaccinale dei riproduttori e dei suinetti svezzati era quello della tabella 1. Il programma antiparassitario preventivo includeva un'iniezione di ivermectina a 14 giorni prima del parto per le scrofe e di 2 volte l'anno per i verri.

L'allevamento era sieropositivo al PRRSv e, un anno prima del caso presente, c'era stata una rottura nei riproduttori e nei grassi (secondo i risultati della PCR, il 30% delle scrofe, il 90% degli svezzati e il 35% dei grassi erano positivi).
Tabella 1. Protocollo vaccinale dei riproduttori e degli svezzati.
| Vaccino | Protocollo |
| Scrofette | |
| Aujeszky | 90º + 120º gg di vita |
| Parvovirus + Mal rosso | 150º + 180º gg di vita |
| Rinite atrofica | 150º + 180º gg di vita |
| PRRSv | 180º + 210º gg di vita |
| Escherichia coli + Clostridium perfringens | 160º + 190º gg di vita |
| Scrofe | |
| Aujeszky | 4 settimane prima del parto |
| Parvovirus + Mal rosso | 2 settimane prima del parto |
| Rinite atrofica | 3 settimane prima del parto |
| PRRSv | 60º gg di gestazione + 6º gg di lattazione |
| Escherichia coli + Clostridium perfringens | 2 settimane prima del parto |
| Verri | |
| Aujeszky | 3 volte l'anno |
| Parvovirus + Erisipelas | 3 volte l'anno |
| Rinite atrofica | 3 volte l'anno |
| Suinetti | |
| Mycoplasma hyopneumoniae | 7º + 21º gg di vita |
| Circovirus suino tipo 2 | gg dello svezzamento |
Comparsa del caso
Si è verificato un eritema multifocale (EM) nella maggior parte (90%) delle scrofe che presentavano sintomi respiratori, ma senza mortalità. Da gennaio 2014 fino alla nostra visita, a maggio 2014, quando le scrofe venivano spostate nei box, in gruppi (~ 30-35 gg di gestazione), queste sviluppavano un EM, caratterizzato da aree cutanee elevate e arrossate sparse per tutto il corpo, particolarmente collo, muso e intorno agli occhi e orecchie (figure 1-3). Inoltre, le scrofe malate presentavano depressione, anoressia, febbre alta 1-3 gg (40 - 41,5ºC), difficoltà locomotorie e sintomi respiratori (dispnea, scoli occulari e nasali con muco e sangue/ figure 4-5). Questi sintomi non venivano osservati nelle scrofe lattanti nè in quelle recentemente svezzate, nemmeno nel capannone delle scrofette, che tuttavia non erano ancora coperte. I segni clinici erano evidenti e duravano varie settimane per la maggior parte delle scrofe (~ 90%) dopo il raggruppamento nei box, valido anche per le gran parentali e le scrofette coperte. Dal punto di vista riproduttivo il 10 - 15% delle scrofe e scrofette coperte, ritornavano in calore dopo il mescolamento nei box (tabella 2).
Tabla 2. Parametri riproduttivi dell'allevamento per il 2014
| Parametro riproduttivo | Mese | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Portata al parto (%) | 72 | 68,7 | 71,4 | 73,8 | 74,9 | 78,1 | 77,3 | 67,4 | 76,3 | 85,0 | 92,5 | 94,2 |
| Aborti (%) | 1,9 | 2,2 | 2,4 | 2,1 | 2,0 | 1,8 | 1,6 | 1,5 | 1,1 | 0,5 | 0,4 | 0,2 |
| Ritorni (%) | 26,0 | 29,0 | 26,0 | 24,0 | 23,0 | 20,0 | 21,0 | 31,0 | 22,5 | 14,4 | 7,0 | 5,5 |
| Vuote (%) | 0,1 | 0,1 | 0,2 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Nati vivi/parto | 13,2 | 13,2 | 13,1 | 13,2 | 13,2 | 13,1 | 13,3 | 13,1 | 13,2 | 12,9 | 13,1 | 13,1 |
| Svezzati/scrofe | 10,7 | 10,9 | 10,8 | 10,8 | 10,9 | 11,0 | 11,1 | 11,1 | 11,2 | 11,4 | 11,6 | 11,8 |


Figure 1-2. Scrofe malate alloggiate in gruppo con EM, con caratteristiche aree rossastre e sopraelevate per tutto il corpo.
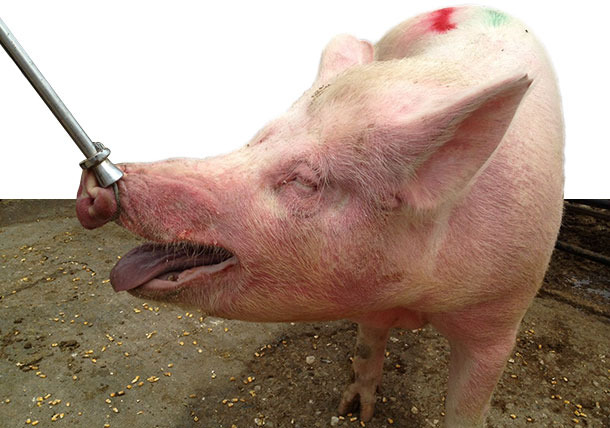
Figura 3. Scrofa malata alloggiata in gruppo con EM, si osservano aree rossastre e sopraelevate sul collo e muso (soprattutto intorno ad occhi ed orecchie).

Figure 4-5. Scrofe malate con EM con depressione del sensorio, anoressia, febbre, dispnea moderata, scoli nasali ed oculari con muco e sangue.
Campionamento ed analisi diagnostiche
A maggio 2014 fu prelevato il sangue di 7 scrofe malate, assieme a tamponi nasali e vaginali di altre 4 scrofe malate ( le scrofe erano tra i giorni 30-45 di gestazione, e avevano da 1 a 5 parti. Inoltre, ad agosto 2014 sono stati raccolti tamponi nasali di altre 7 scrofe malate
I campioni di sangue sono stati testati per: a) PCR quantitativa (qPCR) per PRRSv (PRRSv tipo 1, o europeo, e PRRSv tipo 2, o nordamericano) e per PCV2, e b) ELISA per Actinobacillus pleuropneumoniae (App), Erysipelothrix rhusiopathiae (Ery), PRRSv, ADV gE, peste suina africana (PSAv), peste suina classica (PSCv), e Leptospira spp. I campioni di tamponi nasali furono testati con PCR per il gen apx-IV di App, Bordetella bronchiseptica, Haemophius parasuis, Pasteurella multocida, Streptococcus suis, Citomegalovirus suino (PCMv, rinite da corpi di inclusione) e virus dell'Influenza Suina (SIV) (H1N1, H3N2, H1N2).
Sono stati raccolti anche 2 campioni di sangue (con anticoagulante, in asepsi con attrezzatura sterile) di scrofe malate per successiva coltura, oltre l'analisi biochimica ed ematologica. Nel macello sono stati raccolte le viscere di 7 scrofe malate (pelle, fegato, reni e polmoni) per esame macroscopico e microscopico.
Sono stati raccolti anche campioni di mangimi della fase gestazione e lattazione per la ricerca di micotossine [aflatossine (B1, B2, G1, G2), deoxinivalenolo (DΟN), acetildeoxinivalenole (acetil-DΟN), nivalenolo, zearalenone (ΖEΝ)] mediante il metodo HPLC (Varian 9010 & 9050).
Risultati del laboratorio
I risultati di ELISA e PCR dei campioni di sangue si osservano nella tabella 3. Tutte le scrofe erano sieropositive all'App e PRRSv, ma negative a PSAv, PSCv, ADV e Leptospira spp. Inoltre non si è verificata viremia nè da PRRSv nè da PCV2. I risultati dei tamponi nasali sono descritti nella tabella 4. Non si rilevò : B. bronchiseptica, P. multocida ne PCMv in nessun campione. Lo S. suis si rilevò in tutti i campioni, mentre 1 campione (nº 11) fu positivo all'App, H. parasuis e S. suis. Uno dei campioni presi a maggio fu positivo al SIV.
Tab 3. Risultati delle analisi dei campioni di sangue di 7 scrofe con lesioni cutanee e sintomi respiratori
| Patogeno | Test | Nº di positivi/ Nºtotale analizzati | |
| Maggio 2014 | Agosto 2014 | ||
| Actinobacillus pleuropneumoniae | APX-IV ELISA | 7/7 | 4/7 |
| Erysipelas | ELISA | 0/7 | 0/7 |
| Virus PSA | ELISA | 0/7 | 0/7 |
| Virus PSC | ELISA | 0/7 | 0/7 |
| PCV2 | qPCR | 0/7 | 0/7 |
| PRRSv* | ELISA | 7/7 | 7/7 |
| PRRSv tipo 1 (UE) | PCR | 0/7 | 0/7 |
| PRRSv tipo 2 (USA) | PCR | 0/7 | 0/7 |
| Virus Aujeszky | gE Acs ELISA** | 0/7 | 0/7 |
| Leptospira spp. | ELISA | 0/7 | 0/7 |
*Risultati ELISA anticorpi nei confronti di: PRRSv: < 0,4 negativo; 0,4-0,99 positivo 1; 1,0-1,49 positivo 2; 1,5-1,99 positivo 3; 2,0-2,49 positivo 4; 2,5-2,99 positivo 5; ≥ 3,0 positivo 6
** positivo: infetatto con virus di campo (anticorpi AK gE) - negativo: non infettato con virus di campo (assenza anticorpi AK gE).
***L. Pomona, L. tarassovi, L. canicola, L. grippothyphosa, L. Bratislava: tutti campioni furono < 1:100
Tab 4. Risultati della PCR dei tamponi nasali delle scrofe malate.
| Nº di positivi/ Nº totale analizzati | Patogeni | ||||||
| App | B. bronchiseptica | H. parasuis | P. multocida | PCMv | S. suis | SIV | |
| Maggio 2014 | 1/4 | 0/4 | 1/4 | 0/4 | 0/4 | 4/4 | 1/4 (H1N1) |
| Agosto 2014 | 1/7 | 0/7 | 6/7 | 0/7 | 0/7 | 7/7 | 0/7 |
L'esame dei tamponi vaginali ha evidenziato presenza di E. coli e Streptococcus spp. in tutti i campioni. Gli isolamenti dal sangue furono: Streptococcus spp e Actinobacillus spp, mentre l'antibiogramma ha rivelato la sensibilità a: penicilina, ampicilina e combinazione amoxicillina + acido clavulanico.
Le analisi biochimiche ed ematologiche del sangue hanno indicato una leucocitosi moderata con linfociti atipici e linfopenia (possibilmente secondaria alla deplezione dei linfociti CD4), anemia lieve e trombocitopenia in un caso. In due casi si osservò un'agglomerato di eosinofili superiore a 3000/μL. In due casi, il conteggio totale dei globuli bianchi fu molto elevato, compatibile con un'infezione. L'esame istopatologico della pelle ha evidenziato un aumento della vascolarizzazione del derma, principalmente degli strati superficiali e mediani (figura 6). Non sono stati riscontrate lesioni rilevanti in altri organi analizzati.
Non furono rilevate micotossine nei mangimi di gestazione o lattazione.
Figura 6: L'analisi anatomopatologica della pelle: aumento della vascolarizzazione sopratutto del derma superficiale ed intermedio.
Misure intraprese
Per combattere l'infezione da E. coli e Streptococcus spp., a maggio 2014, le scrofe furono trattate con amossicillina + acido clavulanico a tutte le scrofe il giorno dello svezzamento e 400 ppm di amossicillina nel mangime per 1 settimana dopo il traferimento delle scrofe/scrofette ai box. Inoltre era stato aggiunto acido acetilsalicilico in polvere al mangime delle scrofe malate. Infine, per ridurre l'aggressività da mescolamento, era stato applicato un prodotto commerciale (naturale di erbe), con sapore amaro, localmente intorno al collo e sulla parte superiore delle spalle.
Ad agosto 2014, è stata introdotta la vaccinazione nei confronti del SIV e del H. parasuis di routine per scrofe e scrofette, e nei confronti dell'App per le scrofette da rimonta. Due mesi dopo l'inizio delle nuove vaccinazioni, i sintomi clinici (EM, sintomi respiratori) diminuirono drasticamente.
Evoluzione del caso/Conclusioni
Lo stress interferisce con la risposta immunitaria, per cui le infezioni sono più probabili nei suini sotttoposti a stress, come può essere il mescolamento in gravidanza per la formazione dei gruppi. Inoltre, lo stress può attivare un'infezione subclinica. Nel presente caso clinico è possibile che le scrofe coperte sotto stress dopo il mescolamento, con abbassamento delle difese immunitarie, rendendoli più sensibili a infezioni o alla manifestazione clinica di malattie. E' risaputo che lo stress, le densità elevate sono fattori che influenzano negativamente la risposta immunitaria. Siccome la EM è una reazione di ipersensibilità, può essere stata scatenata da infezioni o malattie, con manifestazioni cliniche di EM con febbre (dovuta ad infezioni da S. suis, H. parasuis e App) e possibilmente dallo stress (dovuto al mescolamento e lotte). La possibilità del coinvolgimento del SIV come agente eziologico è bassa, dato che non si è verificata la diffusione ad altre scrofe, ma solamente ai soggetti raggruppati.
Oggi, dopo il controllo inziale dei sintomi clinici e dell'introduzione delle vaccinazioni ( SIV e H. parasuis, si osserva solamente qualche caso isolato estremamente lieve, sia come numero di soggetti colpiti che come gravità. In questi casi sporadici, sopratutto sono le scrofette ad essere colpite, dopo il solito mescolamento in gruppo in seguito alla copertura (>30-35º gg di gestazione). Il protocollo di trattamento include due iniezioni di amossicillina + acido clavulanico e meloxicam/48h. Alternativamente, è possibile iniettare 2 volte ammossicillina + acido clavulanico/48h e aggiungere acido acetilsalicilico in polvere al mangime per 3 giorni.
Riassumento, lo stress durante l'alloggiamento in gruppi può essere un fattore scatenante di un caso clinico, dato che può attivare un'infezione subclinica o un'interazione con differenti patogeni respiratori, compromettendo la salute e le performance delle scrofe.







