In collaborazione con Joan Lunney (ARS USDA),Jack Dekkers (Iowa State University), e il PRRS Host Genetics Consortium (PHGC), si è stabilito di sviluppare strumenti di carattere genetico e genomico per minimizzare l'impatto della PRRS. L'obiettivo è combinare le tecnologie di ultima generazione della virologia-immunologia e genetica-genomica. L'obiettivo principale è l'applicazione dei risultati nei programmi commerciali di selezione. I tentativi precedenti di identificare geni che forniscono resistenza alle malattie si erano concentrati nel confrontare la risposta alla malattia dei suini in differenti linee pure. Il PHGC non confronta le razze tra di esse, ma si concentra nell'identificazione dei marcatori di resistenza/sensibilità che sono presenti nelle popolazioni suine commerciali che mostrano diversi aspetti della malattia.
Seguendo questo modello, si infettarono sperimentalmente 200 suinetti con ceppi ben caratterizzati di PRRS. Sono stati raccolti dati individuali sul fenotipo della malattia: mortalità, carica virale nel sangue, IMG, valori degli anticorpi neutralizzanti e delle citochine sieriche (vedi figura 1). Il genotipo di tutti i suini con il chip suino 60K SNP e la realizzazione di approfonditi studi di associazioni genomiche, è servito per identificare i vari marcatori correlati con l'evoluzione della malattia clinica e della sua resistenza. L'allelo favorevole in un marcatore importante del cromosoma 4 del suino (Sus scrofa cromosoma 4, SSC4) si associa con un aumento dell'IMG ed una diminuzione della carica virale. Durante i 42 giorni di infezione sperimentale, i suini con il genotipo favorevole hanno incrementato +10% del peso vivo e mostrarono una riduzione della viremia. L'effetto del genotipo benefico è nella grafica della figura 2. I risultati ad oggi, indicano che un beneficio similare dell'allelo favorevole può essere raggiunto in condizioni di campo.

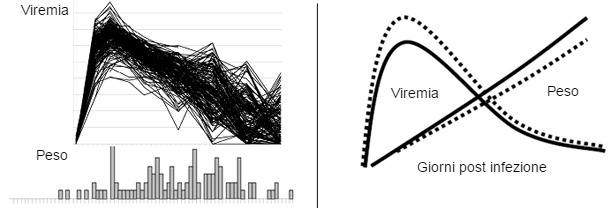
| Fig.1. Fenotipi di PRRS a livello di popolazione. Le figure mostrano viremia di PRRSV (figura superiore) e la distribuzione dell'IMG (inferiore) in 200 suini infettati sperimentalmerinte con PRRSV. I suini si infettarono sperimentalmente a 3 settimane di vita e i dati raccolti a 42 giorni dopo l'infezione. | Fig. 2. L'effetto favorevole del marcatore benefico in SSC4 per l'IMG e per la viremia in suini giovani. Il modello sopra mostra i miglioramenti attesi di IMG e della viremia in suini con presenza di allelo favorevole (AB o BB, linea punteggiata) l'aumento dell'IMG è di circa il 10 %. La diminuzione del picco di viremia è di circa 1 log. |
Si è osservato, che i risultati fenotipici aggiuntivi erano correlati con vari aspetti dell'immunità PRRSV specifia. Per esempio, abbiamo identificato una correlazione negativa tra la carica virale e i titoli sieroneutralizzanati nei confronti del virus. Inoltre, una piccola percentuale di suini infetti ha prodotto una risposta anticorpale unica, che può esser identificata come ampiamente neutralizzante e che aveva la capacità di neutralizzare un'ampia gamma di ceppi, incluso il virus tipo I. Nonostante non si è rilevata una componente ereditaria per la risposta immunitaria, il livello di anticorpi anti-proteine N sì che aveva un componente ereditaria specifica, associata ad un SNP in SSC7. Un marcatore di SSC1 è correlato con vari problemi respiratori nei suini con complesso respiratorio suino. Il marcatore genetico più vicino è localizzato non lontano da un ricettore di citochine infiammatorie.
I risultati di questo studio, realizzato dal PHGC, illustrano evidenze importanti. In primo luogo: la malattia clinica e le conseguenze dell'infezione dal virus PRRS, hanno una componente ereditaria rilevante; secondo: esiste un numero relativamente lmitato di marcatori genomici associati ad un determinato fenotipo di malattia. Questo permette di incorporare la selezione assistita da marcatori per produrre suini con una miglior risposta all'infezione. Infine, al momento tutti i marcatori genomici associati alla malattia clinica e all'immunità si trovano in posizioni del genoma suino immunologicamente importanti, incluso i geni stimolati dall'interferone, geni MHC e geni che rispondono alle citochine.
In conclusione, la genomica e la genetica sono strumenti disponibili per migliorare la salute animale, in particolare per le malattie infettive dove mancano vaccini o trattamenti efficaci. Quando si combina il miglioramento genetico con i vaccini migliori e con una buona alimentazione sarà possibile controllare la maggior parte degli effetti negativi della PRRS endemica.