Gli anticorpi (Ab) o immunoglobuline (Ig):
- Sono prodotte dai linfociti B stimolati dagli antigeni e differenziati in cellule plasmatiche (cellule secretrici di anticorpi, in inglese ASC: Antibody Secreting Cells)
- Secreti dai fluidi corporali extracellulari.
- In grado di unirsi ed attaccare i patogeni strani, neutralizzandoli ed eliminandoli attraverso meccanismi multipli.
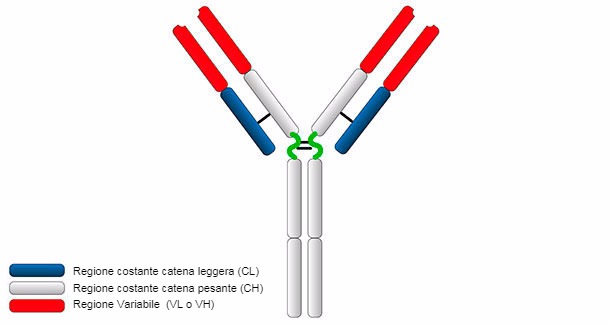
Il monomero di immunoglobulina ha un peso molecolare di 150-180 kDa ed ha un formato che assomiglia ad una Y (Figura 1).

Figura 1. Struttura generale delle immunoglobuline.
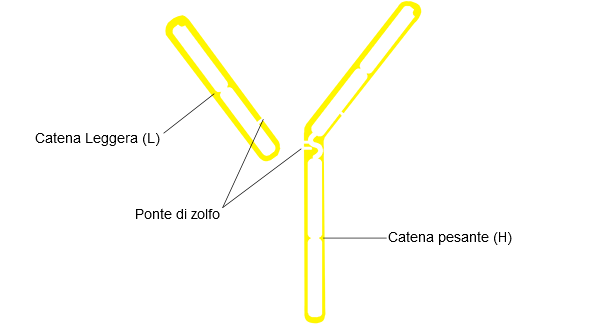
La struttura tipica delle Ig consiste in due catene pesanti (H: heavy) e due catene leggere (L: light) unite da ponti di bisolfuro. Entrambe le catene contengono 2 parti, una regione costante (C) ed una regione variabile (V).
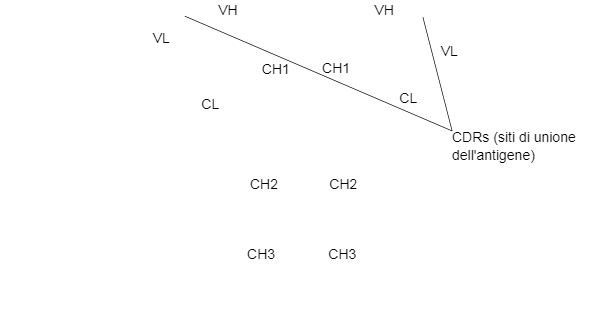
Le catene H e L hanno regioni o domini dove la proteina si piega per formare un'area globulare, denominata VH, CH e VL, CL, rispettivamente. Le catene pesanti sono formate da una parte variabile (VH) e 3 (per IgG e IgA) o 4 (per IgM e IgE) domini costanti denominati CH1, CH2, CH3 e CH4. La catena leggera può essere di tipo λ o κ ed è formata da due domini, uno variabile (VL o VK) e un altro costante (CL o CK). I domini VH e VL hanno regioni altamente variabili denominate CDRs (regioni determinanti della complementarietà) che sono il sito di unione per un antigene specifico.
Esiste una regione bsagra tra CH1 e CH2 che permette la flessibilità delle molecole di Ig. La digestione di questa regione bisagra con proteasi risulta in due frammenti Fab che contengono il sito di unione dell'antigene ed un Fc (frammento cristalizzabile) implicato nelle funzioni di anticorpo.
I domini CH2 e CH3 sono i siti di unione per i recettori Fc, mentre i domini CH1-CL si uniscono al frammento complementare C4b ed il dominio CH2 si unisce al fattore C1q del complemento.
Un batterio possiede differenti epitopi superficiali; durante un'infezione si produrrano differenti anticorpi e ogni anticorpo si unirà agli epitopi specifici sul patogeno.
Le differenti sequenze di amminoacidi della regione costante della catena pesante caratterizzano le differenti classi di anticorpi o isotipi (Figura 2): IgD (catena pesante δ), IgM (catena pesante μ), IgG (catena pesante γ), IgA (catena pesante α) e IgE (catena pesante ε). Le IgM sono secrete come pentameri e le IgA come dimeri secretori.

Sono state descritte alcune subclassi di Ig con differenti catene pesanti, principalmente tra le classi di IgG e IgA.
I differenti anticorpi sono gli effettori dell'immunità umorale nei confronti dei patogeni e pertanto, sono presenti in alte concentrazioni nel siero e altri fluidi biologici, secrezioni mucosali (saliva, latte, colostro, ecc). Il ruolo difensivo degli anticorpi si deve a differenti meccanismi (descritti nella seconda parte di questo articolo)
Le IgG sono immunoglobuline con peso molecolare di circa 108 kDa. Le immunoglobuline IgG sono in maggiore quantità nel siero e negli spazi extravascolari. Le IgG sono sopratutto coinvolte nella risposta di difesa sistemica. Sono efficaci nella neutralizzazione dei virus, nell'interazione con la frazione C1 del complemento e nell'attivazione della cascata del complemento con opsonizzazione e fagocitosi dei patogeni. Inoltre, promuovono la morte delle cellule infette tramite citotossicità cellulare mediata dagli anticorpi (reazioni ADCC -Antibody Dependent Cell-Mediated Cytotoxicity). Il suino ha 6 subclassi di IgG, di IgG1 a IgG6.

I monomeri di IgM con un peso molecolare di circa 108 kDa sono uniti alla superficie delle cellule B ed hanno il ruolo di BCR (Recettori di Cellule B) per il riconoscimento degli antigeni. Le IgM prodotte in forma di pentameri con una forma circolare alla quale si aggiungono 5 subunità di monomeri uniti da collegamenti di zolfo e di una catena J; questo formato pentamerico ha circa 900 kDa di peso molecolare.
La IgM è la prima immunoglobulina sintetizzata quando avviene il primo contatto con l'antigene. Viene secreta principalmente come parte della risposta immunitaria umorale per una prima ed importante difesa contro le infezioni virali e batteriche. La presenza di IgM specifica contro un patogeno nel siero indica un'infezione recente/acuta. Vengono secrete ugualmente durante la risposta secondaria, ma in minor quantità. In questo modo, le regioni Fc sono al centro con 10 siti di unione all'antigene nella periferia. Le IgM sono in grado di unirsi a più molecole del frammento C1 per la via classica e sono altamente efficaci nell'attivazione del complemento per l'opsonizzazione, così come per la neutralizzazione ed agglutinazione dei virus.
I così detti anticorpi IgM naturali (NA: "Anticorpi Naturali" - IgM) sono prodotti da alcuni subcongiunti di linfociti B che possono essere coinvolti nella difesa di prima linea contro la diffusione sistemica degli agenti infettivi.
Le IgA sono la classe predominante di Ig nelle secrezioni (saliva, muco, lacrime, colostro, latte) sulla superficie delle mucose e previene la penetrazione e colonizzazione dei patogeni.
Le IgE sono immunoglobuline di circa 190 kDa di peso molecolare e sono presenti a basse concentrazioni nel sangue. Le immunoglobuline IgE sono specificatamente implicate nell'ipersensibilità tipo I e nella difesa contro i parassiti.
Il monomero IgD hanno come principale ruolo il BCR.