L'integrità dell'epitelio e la secrezione della mucosa rappresentano la prima barriera fisica di difesa contro gli antigeni, le tossine ed i microorganismi. Inoltre, le cellule epiteliali e l'immunità innata producono proteine antimicrobiche (AMPs) in risposta ai patogeni.
La difesa più importante contro i patogeni primari ed opportunisti è rappresentata da cellule dell'immunità innata ed acquisita, associate alle superfici mucosali, organizzate in strutture ben definite denominate tessuti linfoidali associati alle mucose (MALT-Mucosal-associated Lymphoid tissues), es. tessuto linfoide associato all'intestino (GALT), PP (Placche di Peyer), BALT (tessuto linfoide associato ai bronchi), NALT (tessuto linfoide associato al nasofaringe), ecc., o disseminate sull'epitelio e sulla lamina propria.

L'espressione di PRRs, principalmente dei TLRs e recettori tipo NOD (NLRs), nelle cellule epiteliali e di immunità innata modula il riconoscimento e la risposta infiammatoria/immunitaria contro i microbi.
L'immunità della mucosa intestinale si sviluppa dalla nascita, associata alla colonizzazione del microbiota che stimola la maturazione immunitaria e l'espansione delle strutture GALT, il che influenza la comparsa di subpopolazioni effettrici di linfociti e di cellule B implicate nella produzione di IgA. Differenti subpopolazioni di CD4, CD8, linfociti γδT e cellule dell'immunità innata si localizzano nella lamina propria e nell'epitelio (figura 1).
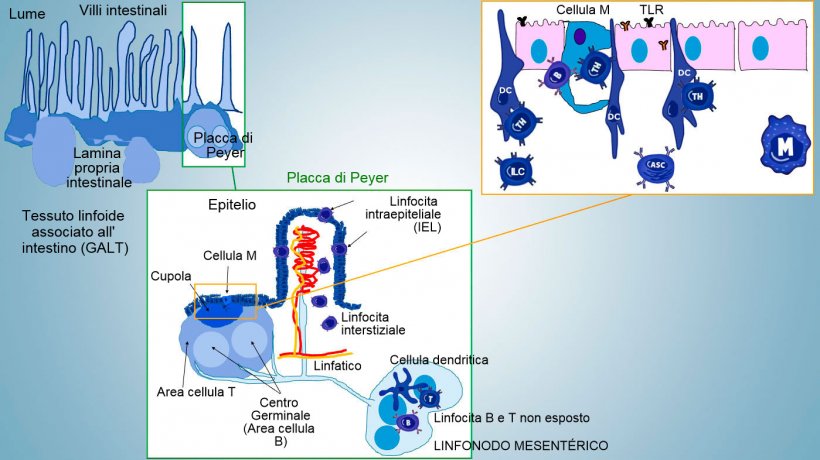
Le subcategorie più importanti di Thelper, che si differenziano nella lamina propria intestinale sono i linfociti T regolatori (Treg), Th1, Th2 y Th17. Le cellule linfoidi innate (ILCs) anche loro hanno un ruolo chiave nella risposta immunitaria delle superfici barriere, interagendo con altre cellule dell'immunità innata ed acquisita, sopratutto con Th17.
Inoltre, il microbiota intestinale inibisce la colonizzazione e la sovracrescita del patogeno nell'offrire segnali che sostengono uno dei meccanismi innati, come per esempio, la secrezione di proteine antimicrobiche (AMPs).
Nel polmone, i linfociti Th1 citotossici CD4 e CD8 sono presenti come cellule effettrici contro il patogeno intracellulare, ma sono anche implicate in altre subcategorie che includono Th2, Th17, Treg e TFh.
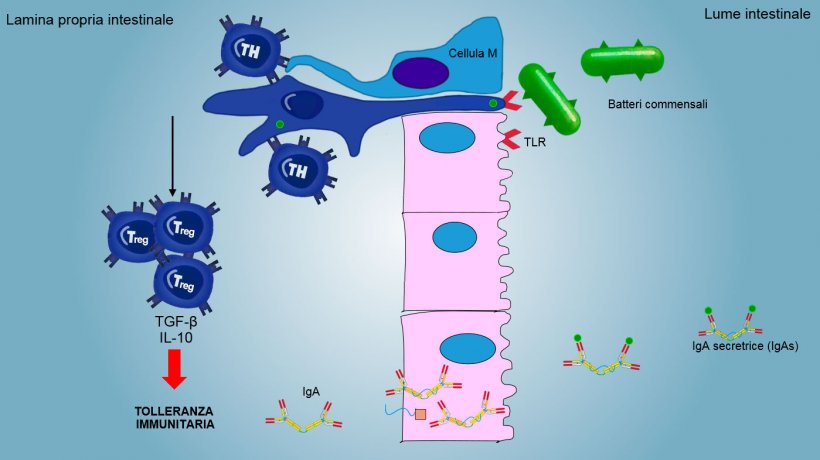
L'immunità della mucosa è in grado di discriminare tra i microorganismi commensali, gli antigeni degli alimenti e i patogeni primari.
Gli antigeni di aerosols ed alimenti, così come la flora commensale, generalmente non stimolano una risposta infiammatoria/immunitaria, ma inducono una tolleranza immunitaria (figura 2).
Funzionalmente, la risposta immunitaria sulla superficie della mucosa si differenzia in siti induttivi e siti effettori:
- Siti induttivi: PP, follicoli linfoidi isolati (ILF), NALT, BALT, linfonodi mesenterici (MLN). Trasformano gli antigeni ini campioni, attivando la risposta immunitaria.
- Siti effettori: lamina propria della mucosa intestinale, tratto respiratorio superiore, tratto genitourinario, ghiandola mammaria e salivare. Genera una risposta difensiva che stimola la risposta immunitaria infiammatoria/innata e specifica.
Nei siti induttivi, gli antigeni sono catturati dalle cellule M (con micropliche) che trasportano internamente e li liberano nello spazio extracellulare, dove sono ancora catturati e trasformati dalle cellule dendritiche subgiacenti; le DC della lamina propria possono anche catturare direttamente l'antigene con le sue prominenze citoplasmatiche, che si estendono tra gli enterociti.
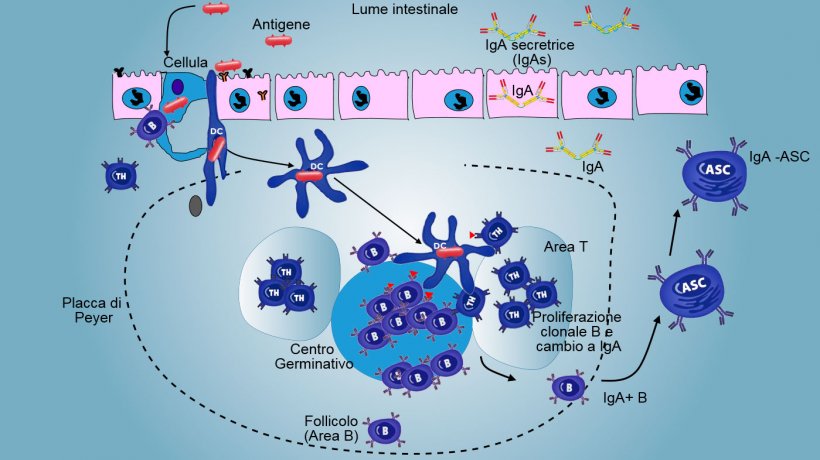
Nelle PP, la presentazione dell'antigene al Thelper fa sì che le cellule B cambino di classe fino alla produzione e secrezione di IgA nella lamina propria e nel lume intestinale come meccanismo effettore difensivo (figura 3). In un altro modo, le DCs intestinali caricati di antigeni, migrano verso i linfonodi mesenterici stimolando una successiva attivazione delle cellule B e T antigene-specifiche; di conseguenza, la migrazione di linfociti B attivati assicura la produzione locale di IgA ed anche di una risposta mucosale a distanza (figura 4).

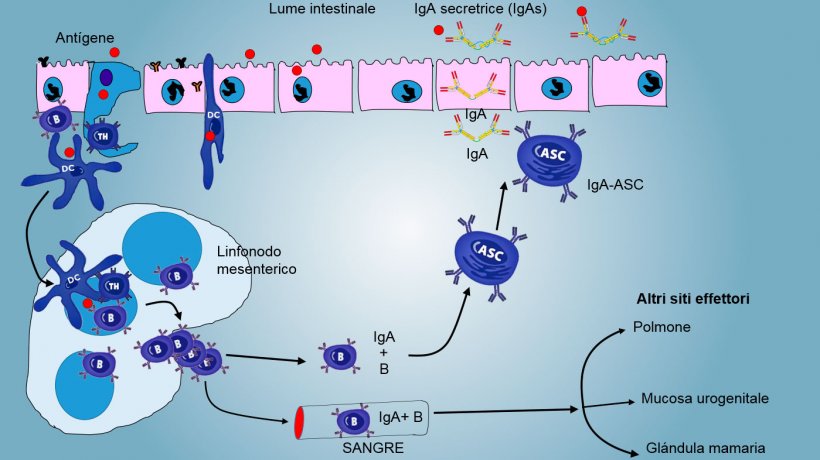
Similarmente, è stato dimostrata la capacità di immunizzazione nasale per conferire una risposta immunitaria sia locale, sia distalmente, mediante il traffico di cellule lontane del tessuto linfoide associato ai bronchi.
Nei siti effettori, la risposta immunitaria varia a seconda del patogeno da affrontare (figura 5).
Nel caso di infezione da patogeno intracellulare, si produce una risposta infiammatoria mediata da TLR e NOD con un'attivazione successiva della risposta immunitaria mediata da Th1 e l'attivazione di cellule NK e linfociti T citotossici in grado di uccidere e distruggere le cellule infette; questa risposta potrebbe essere associata all'attivazione B efficace e di una secrezione di anticorpi di superficie.
I linfociti intraepiteliali γδT sono implicati nell'eliminazione iniziale delle cellule infette o nella secrezione di AMPs, così come l'omeostasi intestinale.
La risposta mediata da Th17 gioca un ruolo critico nella protezione dei siti della mucosa, principalmente contro batteri extracellulari, batteri e funghi,ma anche contro virus, nella lamina propria dell'intestino dove i linfociti sono presenti in quantità abbondanti. Durante una risposta infiammatoria, i linfociti Th17 attivati dai IL-23, producono IL-17 e IL-22, citochine che stimolano la produzione di peptdi antibatterici ed il reclutamento ed attivazione di neutrofili granulociti infiammatori (figura 5).
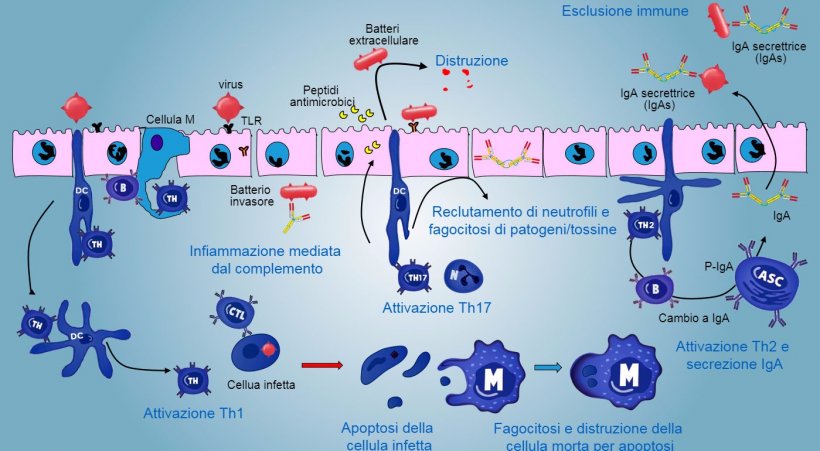
Nel polmone, la protezione contro i patogeni implica la produzione di citochine infiammatorie (TNFa, IL-1β, MIP-1α e MIP-1β) ed il reclutamento di neutrofili, macrofagi e linfociti come cellule T CD4, cellule T CD8 e linfociti Tγδ.
La produzione e secrezioni di IgA secretrici di anticorpi è un meccanismo effettore principale dell'immunità mucosale (figura 6).
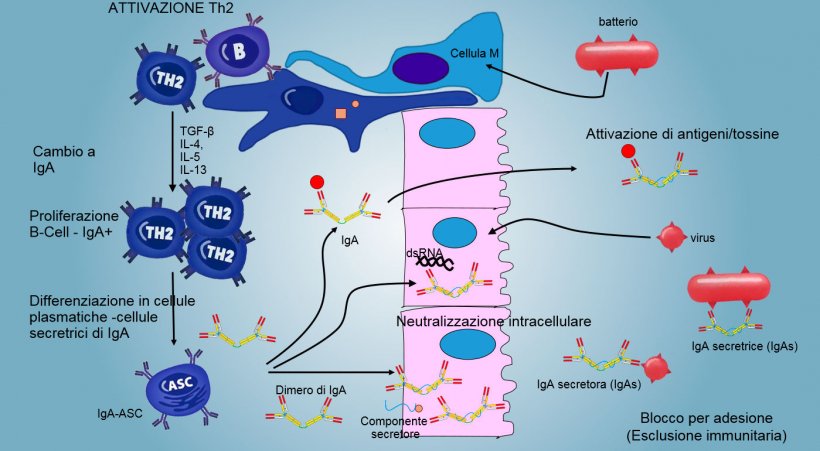
L'IgA predomina su tutte le superifici e secrezioni mucosali; le cellule plasmatiche presenti nel tessuto linfoide o nella lamina della mucosa realizzano una costante secrezione di IgA.
Nelle PP intestinali, l'attivazione dei linfociti B genera cellule plasmatiche secretrici di IgA. Le IgA si producono sopratutto come dimeri di IgA dove i monomeri si uniscono mediante una catena J e si uniscono ad un componente secretore che protegge s-IgA dell'azione di enzimi proteolitici intestinali. Le IgA evitano l'adesione dei virus e batteri sulle cellule epiteliali (meccanismo di immuno-esclusione), sono in grado di unirsi a proteine virali all'interno delle cellule e bloccare la replicazione (neutralizzzione intracellulare), cosí come unirsi agli antigeni che penetrano nella mucosa e sono trasportati attraverso l'epitelio per poi essere eliminati nel lume (eliminazione di antigeni).
Il "cambio" di IgA si regola principalmente mediante l'attivazione dei linfociti Th2 con produzione di citochine TGF-β, IL-4, IL-5, IL-13. Il dimero di IgA secreto si unisce ad un recettore (pIgR) sulla superficie basale delle cellule epiteliali. Il complesso si internalizza nella cellula e dopo aver migrato attraverso la superficie luminale, il recettore si scinde e l'IgA rimane unita al residuo del recettore (componente secretore).
A livello respiratorio, l'IgA predomina nelle zone superiori (cavità nasali, faringe, laringe, trachea, bronchi), mentre le zone inferiori (bronchiali ed alveolari) esiste principalmente una risposta immunitaria sistemica con partecipazione dei linfonodi coinvolti e della secrezione predominante di IgG.






