E' risaputo che esiste una complessa rete di segnali che combinano sistema immunitario e quello neuroendocrino e che giocano un ruolo critico nella modulazione della risposta immunitaria difronte a rischi ambientali (p.es. patogeni, fattori nutrizionali e/o ambientali) sfociando in una risposta sistemica.
L'obiettivo è il mantenimento dell'omeostasi, l'equilibrio dinamico nel quale i continui cambi stabiliscono le condizioni ottimali per la sopravvivenza. La comunicazione dei molteplici settori garantisce il mantenimento dell'omeostasi e pertanto della salute.

Il sistema immunitario ed il sistema nervoso centrale si comunicano attraverso vie anatomiche e ormonali-peptidiche.
I nervi efferenti del sistema nervoso simpatico innervano gli organi linfoidi primari e secondari; si è dimostrato che l'adrenalina e la noradrenalina attiva l'asse ipotalamo- ipofisi-surrenali ed agiscono sui ricettori β2 adrenergici dei leucociti.
Le cellule immuni esprimono recettori per molti ormoni (per esempio, l'ormone adrenocorticotropico, prolattina, ormone della crescita (GH), leptina, glucocorticoidi, estrogeni e testosterone, neurotrasmettitori e neuropeptidi come VIP, sostanza P, norepinefrina, somatostatina e neuro-peptide Y). Allo stesso modo, i tessuti endocrini e nervosi mostrano recettori specifici per le citochine derivate dal sistema immunitario.
In questo contesto, è chiaro che le funzioni delle cellule immunitarie possono essere alterate dagli ormoni neuro-endocrini e che le cellule immunitarie hanno la capacità di produrre ormoni con una risposta neuroendocrina funzionale.
Gli ormoni e le citochine, sopratutto le citochine pro-infiammatorie e regolatrici, sono i principali attori di questa coordinata "conversazione". Le loro azioni si traducono in un miglioramento dell'immunità innata, un controllo dell'infiammazione con un aumento dell'efficacia della risposta immunitaria. Di fatto, si inizia anche come risposta ad una sfida di un patogeno per ristabilire l'omeostasi. Al contrario, un mancato controllo di questa risposta neuro-immunitaria può influenzare negativamente la risposta immunitaria contro i patogeni e l'efficienza metabolica.
In questo sistema di "verifica e di equilibrio", l'evidenza emergente indica un ruolo fondamentale del microbiota intestinale. Il microbiota intestinale interagisce strettamente con il principale sistema neuroendocrino del corpo che controlla vari processi organici in risposta allo stress, l'asse ipotalamo- ipofisi-adrenale (HPA-hypothalamic–pituitary–adrenal). Questa interazione è di grande importanza dato che varie alterazioni dell'asse microbiota-intestino-cervello possono essere associate ad un disregolazione dell'asse HPA e del sistema immunitario inter-correlato.
L'attivazione dell'asse HPA e la secrezione di glucocorticoidi è una delle vie neuroendocrine principali per controllare l'infiammazione locale e sistemica.
Tuttavia, la prolattina ed il GH sono ugualmente coinvolti nello sviluppo ed efficacia della risposta immunitaria. Sono segni che facilitano la proliferazione, differenziazione e funzionalità delle cellule immunocompetenti verso gli stimoli antigenici mediante azione endocrina e paracrina (endocrine and paracrine action). Di fatto, entrambi gli ormoni, che sono identici alle ghiandole endocrine, sono sintetizzate, immagazzinate e secrete dalle cellule immunitarie.
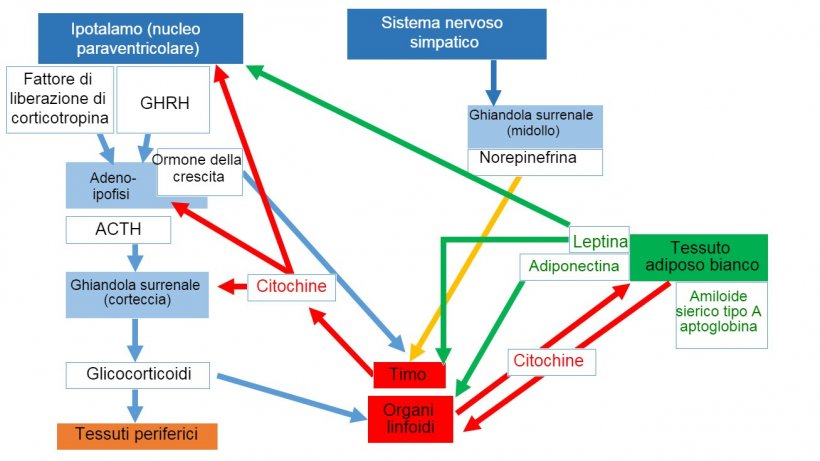
Il tessuto Adiposo Bianco esercita un ruolo fondamentale nella rete neuroimmunitaria che combina stato nutrizionale, metabolismo ed equilibrio energetico per mantenere l'omeostasi corporale. I prodotti che vengono sintetizzati nel tessuto adiposo sono conosciuti come adipocine ed includono fattori anti-infiammatori e pro-infiammatori, come le classiche citochine, ma anche ormoni specifici. I principali ormoni, la leptina e l'adiponectina, sono stati identificati come attori importanti nell'intercomunicazione tra il sistema endocrino ed il sistema immunitario.
La leptina non solo regola il consumo di alimenti ed il metabolismo, ma stimola ugualmente la proliferazione e la sopravvivenza dei precursori linfoidi e lo sviluppo delle cellule T nel timo. Migliora, inoltre, la risposta Th1 aumentando la produzione di IL-2 e IFN-Y dalle cellule T ed i macrofagi.
L'adiponectina include molteplici isoforme ed è l'adipocina più espressa. L'adiponectina, di elevato peso molecolare, agisce principalmente come regolatore anti-infiammatorio mediante la soppressione della differenziazione ed attivazione classica dei macrofagi M1 mediante regolazione negativa delle citochine pro-infiammatorie, ossia, TNF-α e IL-6, agendo sui ricettori 1 dell'adiponectina. Le isoforme di minor peso molecolare sembrano aver un ruolo pro-infiammatorio, aumentando l'attività delle molecole pro-infiammatorie. (Tong et al., 2011; Gomez et al., 2011) (figura 1)
Vari fattori stressanti della produzione intensiva dei suini, come le manipolazioni, fattori di stress ambientale, fattori nutrizionali, lo svezzamento, il mescolamento degli animali, le lotte gerarchiche ed il trasporto possono influenzare negativamente la risposta immunitaria in termini di efficienza funzionale.

E' evidente che le prime settimane di vita costituiscono il periodo più critico per i suinetti per lo sviluppo immunitario, che si caratterizza da una progressiva efficienza. Di fatto, durante il periodo neonatale, i suinetti possono essere esposti a fattori stressanti fisici e psicologici ed a infezioni: tutto può impattare direttamente sull'efficacia della risposta immunitaria.
Lo svezzamento è uno degli eventi più stressanti e che predispone a disfunzioni del sistema immunitario ed intestinale, compromettendo seriamente la salute e la crescita, oltre che il consumo di alimento, particolarmente nella prima settimana dopo lo svezzamento.
Allo stesso modo, le infezioni, sono fattori chiavi che contribuiscono alla riduzione delle performance degli animali zootecnici. Le infezioni persistenti/sub-cliniche possono ugualmente influenzare negativamente gli accrescimenti per interferenza sull'asse ormonale, il metabolismo tissutale e l'efficienza nutrizionale.
Durante l'infezione, l'attivazione dell'asse HPA e la secrezione di glucocorticoidi possono influire sia sulla gravità sia sull'impatto metabolico dell'infezione.
Di fatto, un'infiammazione incontrollata, con probabile danno tissutale, dipende dalla complessa interazione tra i livelli di glucorticoidi, sull'attività periferiche, e, principalmente, i livelli e la persistenza delle citochine pro-infiammatorie (TNF-a, IL-1β, IL-6, IL -15).
L'attivazione dell'asse HPA - GH con il fattore di crescita insulinico tipo 1(IGF1) ed i livelli alterati delle citochine sistemiche possono indurre a cambi metabolici. All'inizio dell'infezione/infiammazione, varie alterazioni metaboliche (aumento dell'GH) possono favorire una risposta immunitaria innata efficace (energia diretta per l'attivazione del sistema immunitario). In seguito, si produce un disaccoppiamento tra i livelli di GH e IGF-1 con soppressione dell'asse GH, resistenza epatica e scheletrica a GH ed inibizione dell'attivazione dell' IGF-1 nei tessuti periferici (Soendergaard et al., 2017). Inoltre, i livelli elevati di glucocorticoidi e citochine pro-infiammatorie (ovvero, IL-1, TNF-α e IL-6) inducono ad una riduzione del consumo di alimento, un bilancio energetico negativo con catabolismo tissutale, degradazione di proteine e amminoacidi, riduzione della biodisponibilità e secrezione di oligoelementi (come Zn e Cu).
Tabela 1. Principali segnali della comunicazione immuno-neuroendocrina
| Ormoni | Glucocorticoidi |
|
| Ormone della Crescita (GH) |
|
|
| Leptina |
|
|
| Adiponectina |
|
|
| Citochine | IL-1, TNFa, IL-6 |
|






















