La diarrea post-svezzamento è una delle principali cause di perdite economiche in suinicoltura. Si caratterizza da un'elevata incidenza di diarrea e da una riduzione degli accrescimenti attibuibili a ceppi enterotossigeni di E. coli. Fattori come lo svezzamento precoce e brusco, tra 17 e 28 giorni di età, generano enorme stress, che comporta uno squilibrio del microbiota intestinale, la fisiologia e la funzione immunitaria della mucosa. La risposta immunitaria della mucosa intestinale è uno dei temi che più riceve attenzione negli ultimi 5 anni. L'epitelio della mucosa è formato da cellule epiteliai, conosciute anche come enterociti, che ricoprono il tratto gastrointestinale. La loro salute, non solo è importante per la crescita e sviluppo del suinetto, ma anche per la loro funzione secretiva e di assorbimento, nonchè essere il più grande organo immunitario del suino: è la prima risposta nei confronti dei microbi presenti nell'intestino.
Le cellule caliciformi che formano parte della mucosa producono muco e mucine che conferiscono una barriera iniziale (figure 1 e 2) (Varum et al. 2010 e Pelaseyed et al. 2014). Le cellule epiteliali della mucosa, anch'esse contribuiscono alla produzione di mucina per questa barriera (Maynard et al. 2012 e Chase et al. 2012). Questa barriera contiena anche peptidi antimicrobici (AMP), prodotti dagli enterociti (figura 2). Questi AMP sono indotti dal microbiota intestinale e dalle cellule killer naturali (NK) e LTi (figura 2) (Chase et al. 2012). Gli AMP (anche denominati peptidi di difesa dell'ospite, HDPs) sono un'importante famiglia molecolare che aiuta a comporre una barriera chimica per limitare l'infezione sulle superfici epiteliali ed attaccare i batteri invasori. Nella specie suina sono stati identificati e caratterizzati oltre 30 HDPs (Maynard et al. 2012). Gli AMPs sono peptidi cationici relativamente piccoli e si trovano basicamente sulla superficie delle mucose e nelle cellule fagocitarie. L'attività antimicrobica e la loro struttura, sono variabili e possono modificarsi funzionalmente. Le concentrazioni di alcuni HDPs aumentano in seguito ad una infiammazione o infezione microbica. L'IgA secreta (sIgA) viene prodotta quando in presenza di IgA dimerica a sua volta prodotta da cellule plasmatiche della lamina propria, viene trasportata alla superficie mucosale presso le cellule epiteliali (figura 2) (Maynard et al. 2012). L' IgA secreta ha un ruolo importante nell'immunità della superficie mucosale attraverso l'agglutinazione degli antigeni infettivi, rendendo difficoltosa la loro adesione alle cellule epiteliati e neutralizzano le tossine. La barriera mucosale interna, assieme agli AMP e le sIgA, formano una "zona letale" attraverso la quale pochi patogeni o agenti comensali possono penetrare (figura 2). Questa "zona letale" , supportata dalle strette unioni che hanno gli enterociti, formano un "muro" nei confronti degli E. coli ed altri patogeni enterici.

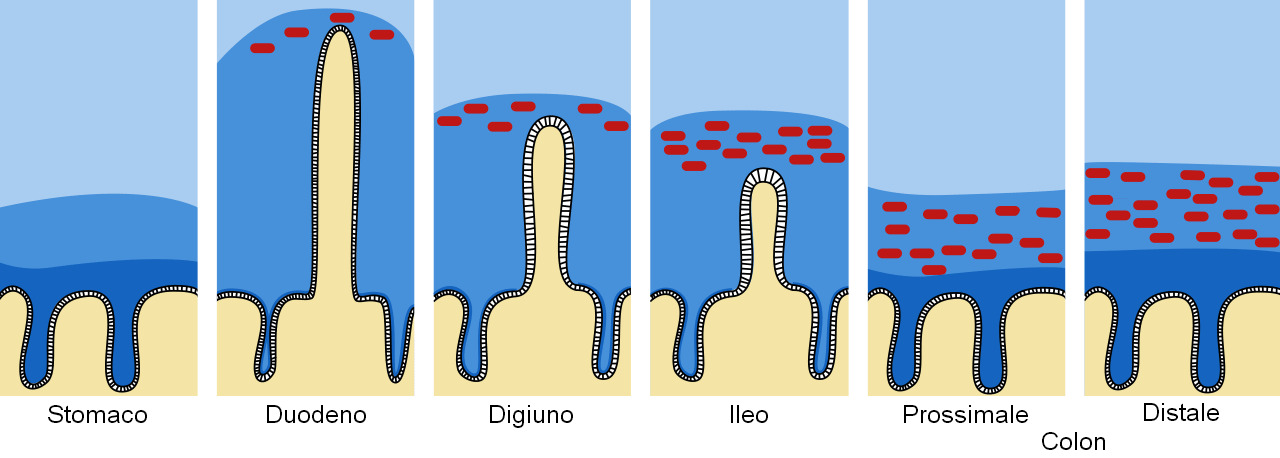
Figura 1. Barriera di muco e mucina nel tratto intestinale. Il muco si evidenzia in colore blu scuro e i batteri in rosso. Adattato da Pelaseyed T. et al. (2014). Immunological Reviews, 260(1), 8–20.
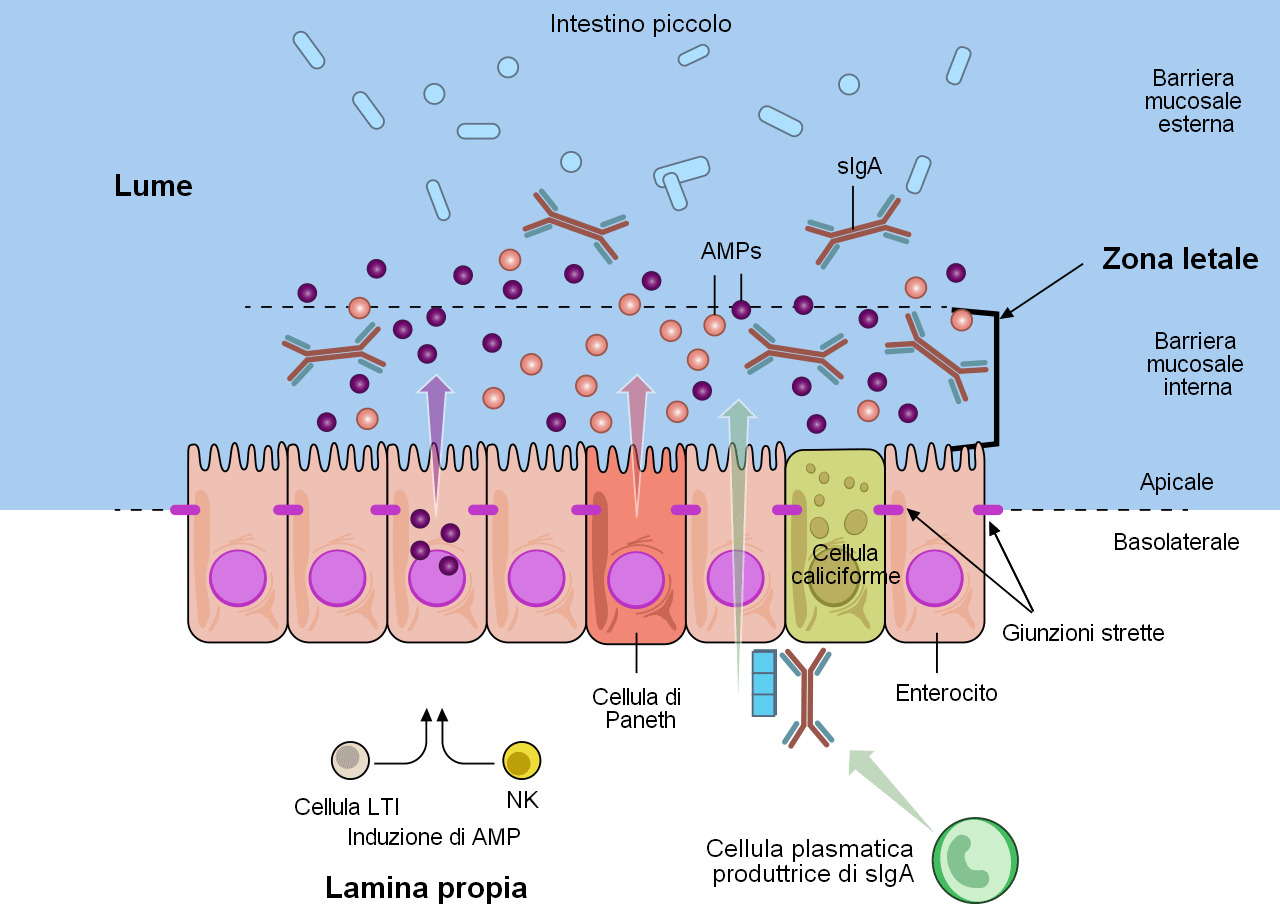
Figura 2. Le difese della mucosa del tratto gastrointestinale. Varie subpopolazioni di cellule epiteliali dell'intestino (IECs) sono integrate con una copertura unicellulare continua che si dividono in una regione apicale ed una basolaterale per le unione strette. Gli enterociti e le cellule specializzate di Paneth identificano il microbiota per indurre la produzione di pepetidi antimicrobici (AMPs). Le cellule caliciformi producono mucina, la quale si organizza in un gel denso di proteoglicani molto retificato formando un rivestimento aderente interno ed un rivestimento esterno meno retificato. Il rivestimento esterno è molto colonizzato dai componenti del microbiota. La mucosa interna è fortemente impermeabilizzata nei confronti della colonizzazione o penetrazione batterica dovuto alla grande concentrazione di AMPs battericidi, così come le IgA secrete specifiche (sIgA), che si dislocano dalla superficie basolaterale, dove sono allacciate da un recettore presente nel rivestimento interno della mucosa. Come risposta al microbiota, le cellule linfoidi innate, le cellule induttrici del tessuto linfoide (LTi) e le cellule natural killer (NK), producono citochine che stimolano la produzione di AMP e mantengono la barriera epiteliale. Adattato da Maynard et al., Nature 489, 231–241 2012
Ci sono altri componenti della risposta immunitaria che possono essere altretanto importanti nella protezione nei confronto di vari tipi di infezione della superficie mucosale. Nei suini, i neutrofili possono migrare massivamente verso il lume intestinale come risposta ai complessi antigeno-anticorpo e uccidere i E. coli. L'arrivo dei neutrofili nel lume intestinale e la sua posteriore distruzione porta ad un aumento della concentrazione di lattoferrina, lisozime e proteine cationiche. Queste sostanze contribuiscono ugualmente all'immunità nei confronti delle infezioni batteriche intestinali (Maynard et al. 2012).
Lo svezzamento dei suinetti è un evento stressante. Lo svezzamento precoce, prima delle 3 settimane di età, porta ad effetti negativi a lungo termine sul sistema immunitario e sullo sviluppo della mucosa. Lo svezzamento precoce a 17-21 giorni di età genera un aumento prolungato degli ormoni dello stress, del fattore liberatore di corticotropina (CRF) e dei mastociti, che a loro volta porta ad una disfunzione della mucosa intestinale (Chase et al. 2012).
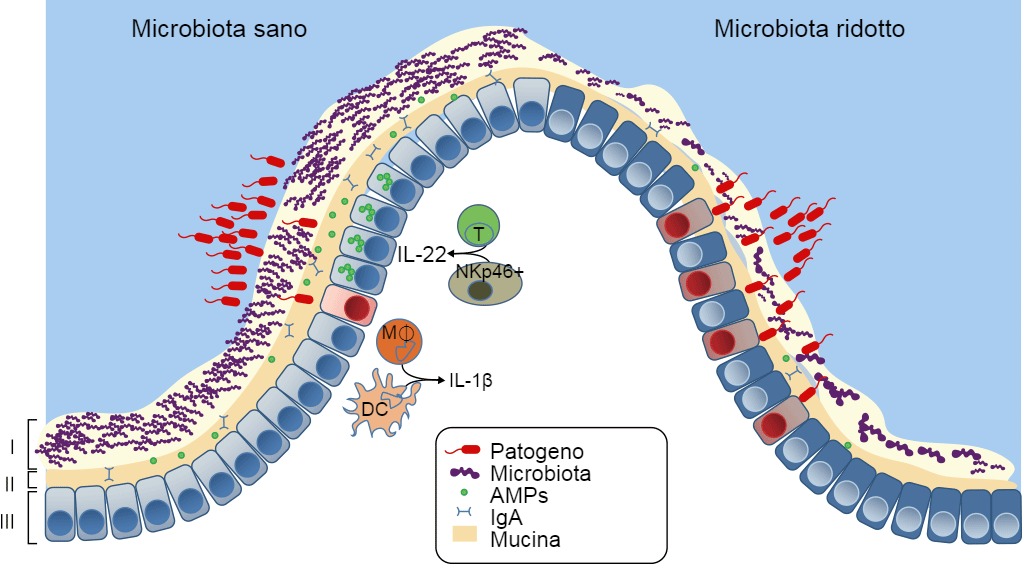
Figura 3. Difese della mucosa sana o in presenza di disbiosi. Il microbiota intestinale offre 3 livelli di protezione nei confronti di un'infezione enterica. (I) Il microbiota satura le zone di colonizzazione e compete per i nutrienti limitando l'associazione dei patogeni con il tessuto dell'ospite. (II) Zona letale- i microbi commensali preparano la barriera immunitaria inducendo l'espressione della mucina, dell'immunoglobulina A (IgA) e dei peptidi antimicrobici (AMPs) che servono anche per prevenire il contatto con i patogeni della mucosa dell'ospite. (III) Infine, il microbiota miglora la risposta immunitaria verso i patogeni invadenti. Questo avviene con il potenziamento dell'espressione dell'IL-22 da parte delle cellule T e NK, aumentando la resistenza epiteliale nei confronti dell'aggressore; non solo, iniziando la secrezione di IL-1b da parte dei monociti intestinali (MK) e delle cellule dendritiche (DCs) , porta all'attivazione del reclutamento delle cellule infiammatorie verso il locale d'infezione. Se il microbiota non c'è, esiste meno competizione, meno resistenza della barriera e meno difese immunitarie nei confronti degli aggressori, Current Opinion in Microbiology 2013, 16:221–22
Lo stress della separazione dalla madre, l'età dello svezzamento, l'arrivo in un nuovo ambiente e la sospensione immediata ed improvvisa dell'assunzione di latte materno, alterano l'ecosistema microbico intestinale, si riducono le difese verso i patogeni ed aumenta il rischio di malattie, in particolare della diarrea post-svezzamento (Fouhse et al. 2016). La diarrea post-svezzamento si caratterizza per la riduzione di batteri commensali, come i Lactobacillus spp, e per l'aumento degli E. coli patogeni (Fouhse et al. 2016). Questa situazione genera una disbiosi - perdita di batteri buoni con aumento dei batteri cattivi come gli E. coli (Fouhse et al. 2016 e Khosravi et al. 2013) (figura 3). Tuttavia, la disbiosi non è solo la perdita di microbiota, ma comporta anche la riduzione della "zona letale" —la barriera di muco che si assottiglia, le quantità di sIgA e AMP che si riducono notevolmente; con l'indebolimento della barriera si permette che gli E. coli enterotossigeni entrino in contatto con la mucosa e causino malattia. Uno dei fattori principali che determinano la disbiosi e la diarrea post-svezzamento è la riduzione del consumo di acqua ed alimento (Fouhse et al. 2016). L'anoressia post-svezzamento e la disidratazione causano cambi strutturali nell'intestino: atrofia dei villi intestinali ed iperplasia delle cripte, il che porta anch'esso alla disfunzione della barriera intestinale (McLamb et al. 2013). Gli svezzamenti precoci a meno di 20 giorni di età, compromettono la risposta immunitaria innata, con una riduzione dei numeri di neutrofili e di citochine infiammatorie, necessari per il controllo delle infezioni da E. coli nel post-svezzamento (McLamb et al. 2013). Tanto per peggiore le cose, la riduzione dei batteri che producono acido lattico (Lactobacillus), provocano un aumento del pH intestinale, aumentando la sensibilità alle malattie, dato che il pH basso ha un potere battericida sugli E. coli (Fouhse et al. 2016). Le richerche impegnate nell'aumentare i microbismo simbiotici e ridurre la popolazione dei patogeni opportunisti, si focalizzano nel ridurre la disbiosi.


