La patogenesi e le lesioni causate dall'infezione da PRRSV, dipendono molto dalle caratteristiche comuni tra i virus appartenenti al genere Arterivirus: (i) capacità di entrare e replicare nelle cellule diana, in questo caso i macrofagi; (ii) viremia prolungata dopo l'infezione; (iii) infezione persistente di lunga durata (non permanente). La fase acuta della viremia nei suini da ingrasso dura circa 4 settimane, dopo questo periodo, il virus si troverà principalmente nel tessuto linfoide - normalmente durante il resto della sua vita per un animale da produzione - e periodicamente si può ripresentare la viremia (revisionato in dettaglio da Chand et al. 2012, Curr Opin Virol).
Le lesioni indotte dai virus respiratori sul tessuto polmonare possono svilupparsi in 2 modi: sregolando, per distruzione diretta i pneumociti e/o infettando le cellule infiammatorie ed immunitarie che portano al danno tissutale mediante la liberazione di citochine attive o metaboliti nocivi. Queste cellule attivate possono reclutare altre cellule infiammatorie fino alla sede d'infezione, aumentando il danno tissutale, inoltre, hanno un ruolo importante nell'eliminazione virale e nella regolazione dell'infiammazione.

Le cellule diana nelle infezioni da PRRSV sono i macrofagi alveolari. Il danno tissutale è la conseguenza dell'apoptosi diretta (e necrosi) di queste cellule - in maggior misura - delle cellule vicine (effetto bystander) dovuto alla liberazione di citochine apoptogeniche, specie reattive all'ossigeno e all'ossido nitrico. Allo stesso tempo, si liberano citochine proinfiammatorie che sono responsabili del reclutamento di altre cellule infiammatorie e alcune di queste causano sintomatologia sistemica : febbre, letargia, ecc. Le citochine antiinfiammatorie e le regolatrici sono ugualmente secrete. E' ben documentato che, come altri virus, il PRRSv è capace di sopprimere la risposta primaria dell'interferone tipo I - un potente meccanismo antivirale dell'immunita innata - nelle prime fasi di infezione, attraverso le proteine non strutturali, il che permette loro di replicarsi e diffondersi efficacemente. Sicuramente, differenti ceppi di PRRSv hanno differenti capacità immunomodulanti per cui i sintomi clinici, le lesioni ed il risultato globale dell'infezione dipende molto da quanto sono efficaci i meccanismi appena descritti. Il danno/distruzione dei macrofagi può facilitare la comparsa di infezioni secondarie come normalmente avviene in condizioni di campo.
Nelle infezioni sperimentali realizzate in allevamenti isolati, i sintomi clinici e le lesioni osservate dipendono molto dalla patogenicità del ceppo utilizzato nell'inoculazione degli animali. Le lesioni respiratorie più severe si osservano tra i giorni 7–14 post-infezione. Macroscopicamente, si tratta di aree polmonari consolidate, scure, a macchie nei lobuli più gravemente colpiti, i cranioventrali, però è possibile la diffusione per tutto il tessuto polmonare (foto 1). Le principali lesioni istopatologiche includono:(1) ipertrofia e iperplasia dei pneumociti, (2) infiltrazione mononucleare interlobulare, (3) resti necrotici intralveolari, (4) accumulo intralveolare di cellule infiammatorie e (5) accumulo perivascolare di cellule infiammatorie.
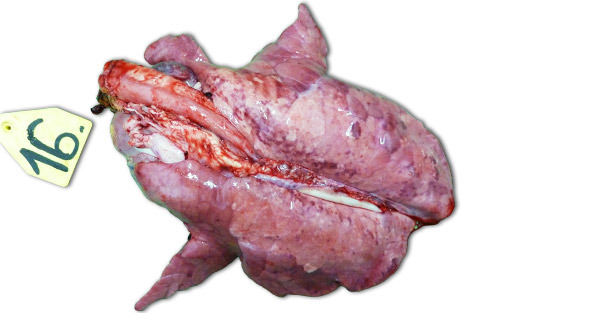
Foto 1. Polmoni di un suino sacrificato a 14 gg PI, inoculato con un ceppo ad alta virulenza tipo I subtipo 3 "Lena".
In uno studio "challenge" nel quale i suini sono stati sacrificati a 14 e 21 giorni post-infezione, nei suini infettati si osservò una diminuzione significativa dei resti necrotici intralveolari e delle cellule infiammatorie intralveolari il giorni 21 PI; in cambio, si osservò solamente una piccola alterazione nelle altre 3 categorie. Questi referti possono essere spiegati dal fatto che la formazione dei resti necrotici intra alveolari ed il conseguente accumulo intralveolare di cellule infiammatorie (basicamente neutrofili) riflettono la fase acuta della malattia(foto 2), nella quale le sostanze nocive liberate dai macrofagi infetti causano un grande danno tissutale. Dopo la fase iniziale ed acuta – in assenza di infezioni secondarie – il sistema immunitario ed i meccanismi naturali di guarigione, rimuovono il tessuto necrotico, facendo scomparire le cellule di infiammazione acuta (granulociti neutrofili), gli alveoli si svuotano e i pneumociti danneggiati sono sostituiti da pneumociti proliferativi tipo II.
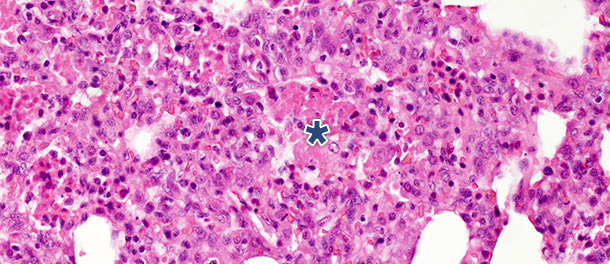
Foto 2. Resti necrotici intralveolari e accumulo di cellule infiammatorie (asterisco) nel tessuto polmonare a 10 giorni post-infezione con un ceppo di PRRSV tipo 1 subtipo 1. H.E. 200×
I pneumociti tipo II sono cellule cuboidali che normalmente sono posizionate tra le pareti alveolari. Nel tessuto polmonare dei mammiferi sono fatti al 60% di cellule alveolari epiteliali, ma solamente il 5% ricopre la superficie alveolare. I loro ruolo più importante è la sintesi, secrezione e riciclo del surfactante polmonare, che riduce la tensione superficiale alveolare, prevenendo il collasso durante la respirazione. L'altra funzione importante dei pneumociti tipo II è il loro potenziale potere proliferativo. Quando i pneumociti tipo I sono danneggiati, i pneumociti tipo II fungono da cellule progenitore per sostituirli e con il tempo, si differenziano in pneumociti tipo I. Nel "challenge" descritto sopra, il numero di dette cellule aumentò significativamente al giorno 10 PI (foto 3) e non è calato al giorno 21 PI. Nonostante lo studio terminasse al 21° giorno PI, non si osservò una guarigione istologica totale (restitutio ad integrum) nel gruppo infettato: i suini hanno recuperato dalla malattia clinica e l'elevato numero di pneumociti tipo II dopo l'inoculazione sia nella fase iniziale sia nella fase finale della malattia dimostrano la loro importanza nella ricostituzione del tessuto polmonare (descritto in dettaglio da Balka et al. 2013. J Comp Pathol).
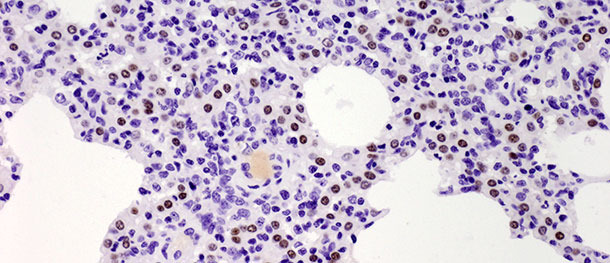
Foto 3. I punti marron indicano il nucleo dei pneumociti tipo II identificati con anticorpi anti-TTF-1. Si osservò un aumento significativo del numero di cellule positive a 10 giorni PI con un ceppo tipo I subtipo 1. IHC 200×








