L'industria suinicola globale ha subìto grandi cambiamenti negli ultimi 30 anni. I piccoli allevamenti a ciclo chiuso in un sito unico condotte dal proprietario si sono convertite in gran parte a sistemi produttivi in 3 siti ad origine multipla. La domanda da parte del consumatore per una carne suina di elevata qualità e a basso costo ha determinato l'aumento della rimonta in allevamento, la riduzione della mano d'opera, dei veterinari ed ha aumentato le distanze tra allevamenti con l'aumento della frequenza dei trasporti. Attualmente le decisioni prese hanno a carico più suini, più allevamenti e regioni come mai è successo in precedenza. Per questo motivo l'opportuna identificazione delle cause e delle dinamiche delle malattie sono critiche per la redditività e la sostenibilità dell'attività.
Il continuo cambio genetico tipico della PRRS e l'elevata frequenza della trasmissione tra allevamenti fanno di questo virus un agente estremamente difficile da controllare. Il monitoraggio si definisce come la raccolta sistematica di informazioni su una malattia ed il suo effetto sulla produttività di una popolazione. La vigilanza, al contrario, è una forma più intensiva di raccolta dati che include: raccolta, registrazione ed analisi dei dati, così come della diffusione delle informazioni tra le parti interessate affinchè possano adottare misure di controllo della malattia (Thrusfield, 2005). In questo articolo si è utilizzato il termine "vigilanza" perchè è l'obiettivo unico della produzione suinicola a realizzare azioni per la prevenzione o controllo delle malattie.
Nel progettare un programma di vigilanza per la PRRS per un allevamento, filiera o regione, si definisce il numero di campioni, i test diagnostici da utilizzare, il metodo di raccolta dei campioni, l'età degli animali da campionare, il livello di confidenza desiderato e la frequenza del campionamento in base a:

- Obiettivo produttivo: il costo di non identificare il virus PRRS o farlo in ritardo in un centro verri o in un allevamento da moltiplicazione è molto più elevato rispetto ad un allevamento commerciale; per cui il livello di confidenza desiderato ( e di conseguenza il numero dei campioni) deve essere superiore (Tabella 1).
- Rischio di introduzione di malattie: la biosicurezza, la densità suinicola e la prevalenza del virus PRRS in una zona devono influenzare la frequenza del campionamento. I campioni devono essere raccolti con più frequenza se il rischio è più elevato. Si consigliano metodi di raccolta alternativi come l'uso delle corde per i fluidi orali quando si applicano programmi intensivi.
- Infezioni precedenti o stato vaccinale: il virus PRRS è più facilmente identificabile in popolazioni negative rispetto ad allevamenti infetti in precedenza oppure vaccinati. In condizioni di rischio elevato i protocolli di vigilanza devono essere adattati con la finalità di mantenere l'immunità dell'allevamento attraverso l'esposizione del virus PRRS selvaggio oppure vivo modificato.
Tabella 1. Numero di campioni individuali richiesti per il rilevamento di almeno uno positivo secondo i vari livelli di confidenza e prevalenza stimati (Epi-Tools).
| Livello di Confidenza | ||||
| 80% | 95% | 99% | ||
| Prevalenza stimata | 1% | 162 | 302 | 463 |
| 5% | 32 | 60 | 91 | |
| 10% | 16 | 29 | 45 | |
| 30% | 5 | 9 | 1 | |
La raccolta e l'analisi dei campioni per rilevare e differenziare il virus PRRS così come la raccolta e l'analisi delle informazioni epidemiologiche correlate ad ogni caso rappresentano un investimento importante da parte degli allevatori e dei loro veterinari. Per giustificare questo investimento i risultati devono produrre informazioni utili che possano portare ad una riduzione del rischio, la valutazione degli interventi e/o correzioni dei programmi di controllo. I principali fattori di un programma di vigilanza per la PRRS includono:
1.- Definizione degli obiettivi
Si possono avere differenze minime tra allevamenti, filiere o regioni, ma in generale, questi programmi sono destinati a:
- facilitare la rapida identificazione del virus PRRS,
- prevedere informazioni opportune per tentare di contenere le "rotture" e minimizzare le perdite
- Identificare la probabile fonte di infezione e/o
- analizzare l'evoluzione della prevalenza del virus e la diversità genetica nel sistema o regione
2.- Ottimizzazione dell'uso delle risorse disponibili
Assegnare un investimento adeguato al programma di vigilanza non è un lavoro facile. “Non fare nessun campione nè realizzare nessuna analisi che non alteri il corso delle azioni del protocollo”. Tra i vari paesi si possono avere differenze significative nella disponibilità di diagnostica, ma è essenziale considerare i pregi e i difetti di ogni tipo di test e di metodo di campionamento ad ogni situazione (Figura 1). Tra i test diagnostici che identificano il virus PRRS abbiamo la reazione in catena della polimerase (PCR) nel siero, seme, fluidi orali, ambiente, aerosol o tessuti; isolamento virale (IV) dal siero, fluidi orali, seme, aerosol o tessuti e l'immunoistochimica (IHC) da tessuti linfoidi o polmoni. Il test di immunoassorbimento legato a enzimi (ELISA) è la scelta come test standard per l'identificazione degli anticorpi anti PRRSV nel siero e fluidi orali. Nessuno di questi test sono in grado da soli di determinare con precisione lo status di eliminazione in una popolazione; la prova biologica o l'uso di animali "sentinella" sono le forme migliori di rilevare l'eliminazione (Figura 1). Oggi i veterinari di suini possono richiedere il sequenziamento dell' ORF 5 nel siero o fluido orale positivi attraverso PCR per identificare il virus isolato in quel momento in allevamento.
Figura 1. Capacità degli strumenti diagnositici nel rilevare antigeni o anticopri PRRS durante l'infezione.
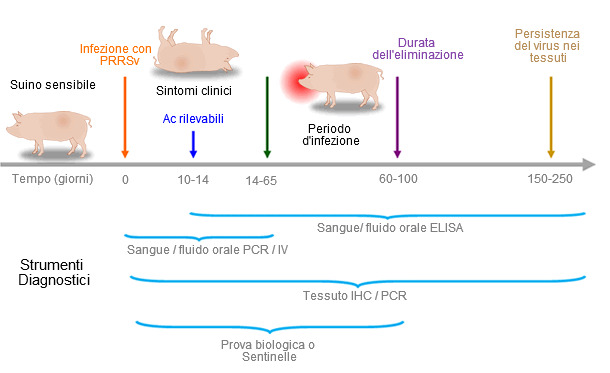
Nell'America del Nord si analizzano: (a) fluidi orali tramite ELISA nelle scrofette negative o in suini in fasi di crescita, (b) fluidi orali tramite PCR in scrofette positive o vaccinate, (c) campioni individuali di siero tramite ELISA per le scrofe (d) pools di sieri tramite PCR per allevamenti positivi, vaccinati o stabili.
3.- Identificare i fattori di rischio e la malattia
Oggi la complessità dell'industria suinicola e la necessità di avere informazioni utili richiedono l'applicazione di programmi di vigilanza completi che misurino:
- Incidenza: numeri di casi nuovi (introduzione di un nuovo ceppo di virus PRRS) rilevati in una regione o filiera durante un periodo di tempo.
- Prevalenza: proporzione di allevamenti infetti in una regione o filiera in un dato momento.
- Rischio: la probabilità che un nuovo ceppo di virus entri in allevamento in un dato momento. Nonostante sia difficile questa stima, è possibile valutare il rischio attraverso questionari di biosicurezza provati nel tempo (http://vdpambi.vdl.iastate.edu/padrap/default.aspx).
- Diversità genetica: rappresentazione di tutti gli isolamenti virali identificati in una filiera o regione.
4.- Protocollo di monitoraggio
La sensibilità a livello di allevamento (HSe, sigle in inglese) è la probabilità di trovare un positivo in un allevamento positivo; la specificità a livello d'allevamento (HSp, sigle in inglese) è la probabilità di avere un negativo in un allevamento non infetto. Sia il HSe come HSp sono influenzati da Se(sensibilità) e Sp(specificità) dei test individuali, del numero di animali testati e dalla prevalenza reale dell'infezione in allevamento. Nella maggior parte delle situazioni quello che si cerca è un protocollo con elevato HSe ad un prezzo "ragionevole".
Le informazioni di valore che possono indicare un cambio nello status dell'infezione in una popolazione e che possa mostrare alterazione dello status dell'infezione di una popolazionea avviene principalmente da tre fonti:
- Storico: informazione verificata a partire dagli eventi come: vaccinazioni, esposizione intenzionale al virus, entrata di animali con status conosciuto per la PRRS, ecc. Questi dati permettono una distribuzione strategica delle risorse se la fonte di informazione è precisa e opportuna.
- Vigilanza passiva: i risultati dei test diagnostici realizzati in funzione dei sintomi clinici: il veterinario viene chiamato in presenza di situazioni anomale. Si raccolgono campioni di sangue, fluidi orali e/o tessuti durante la "visita di emergenza" da analizzare con PCR e/o ELISA.
- Vigilanzia attiva: i risultati delle diagnostiche periodiche indicano la presenza o assenza di virus PRRS. Vedi esempio nella Tabella 2.
Tabella 2. Esempio di un protocollo di analisi di campioni per un protocollo regolare di vigilanza per la PRRS.
| Tipo di allevamento | Status di infezione per il virus PRRSV (AASV) |
Età dei suini / frequenza  |
Tipo di campione | Numero di campioni | Test diagnostico |
| Scrofaia Sito 1 | Negativo (IV) | Adulti / trimestrale | Sangue | 10-30 | ELISA |
| Stabile (II) o Positivo (I) | Suinetti / mensile | 30-60 | PCR e Sequenziamento | ||
| Scrofaia (ciclo chiuso) | Negativa (IV) | Adulti / trimestrale | Sangue | 10-30 | ELISA |
| Stabile (II) o Positivo (I) | suini di 6-10 settimane / mensile | Fluido orale | 30-60 | PCR e Sequenziamento | |
| Svezzamento o ingrasso | Negativo (IV) | 4 settimane dopo l'entrata in situazione di tutto pieno/tutto vuoto o trimestralmente in flusso continuo | Siero | 10-30 | ELISA |
| Fluido orale | 1-4 corde/ 1000 suini o capannone | ||||
| Positivo (I) | Sangue | 10-30 | PCR e Sequenziamento | ||
| Fluido orale | 1-4 corde/ 1000 suini o capannone |