Si stima che i nostri suini abbiano un totale di 1010-1012 batteri nell'intestino, un numero che moltiplica il numero totale di cellule nel corpo di 10 (Luckey, 1972). È essenziale prendere in considerazione questa componente batterica durante la progettazione delle diete per i nostri animali, poiché attraverso un microbiota più sano e più favorevole per il suino, possiamo influenzare direttamente un processo di digestione più efficiente, migliorando il sistema immunitario e aumentando le performance produttive.
L'influenza sul microbiota può essere esercitata nei seguenti modi:

Modificando la disponibilità dei nutrienti per determinate specie batteriche
In generale, i batteri del colon prossimale producono una grande quantità di nutrienti, provenienti da residui non digeriti della dieta nella sezione dell'intestino tenue, che è ridotta e limitata quando raggiungiamo le regioni distali.
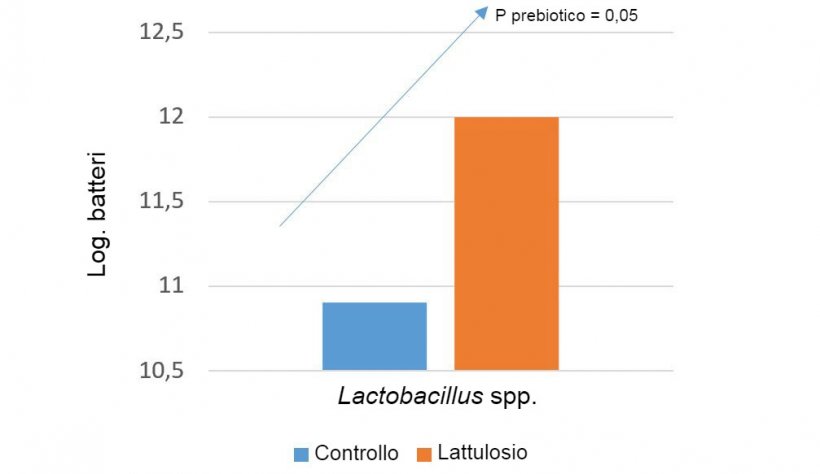
Una delle strategie per influenzare questo aspetto sono i prebiotici. Il concetto di prebiotici iniziò quando fu osservato che l'inulina ed i frutto-oligosaccaridi (FOS) stimolavano i bifidobatteri, che sono considerati buoni per la salute intestinale (Gibson e Roberfroid, 1995). Attualmente vi è molta letteratura sui suini che supporta l'uso dei prebiotici per selezionare Bifidobacterium spp., Lactobacillus spp., Bacteroides spp., ecc...È anche attribuita questa capacità di influenzare il microbiota all'inclusione nella dieta di un certo livello di fibra fermentescibile, per stimolare la fermentazione nel colon (Correa-Matos, 2003); alla riduzione dei livelli proteici nella dieta, per evitare la fermentazione proteica (Pérez, 2013); e all'inclusione di enzimi esogeni, quando si producono oligosaccaridi con effetto prebiotico da polisaccaridi non amilacei (Bedford, 2004).
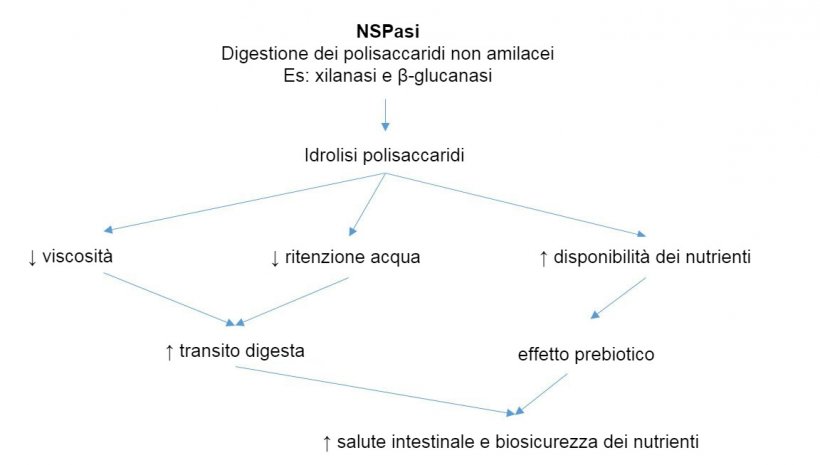
A sua volta, è anche possibile pianificare un trattamento probiotico con l'obiettivo di modificare i nutrienti presenti nell'intestino. Per cominciare, una strategia può essere progettata per ridurre i nutrienti specifici e compromettere la crescita dei batteri patogeni, incoraggiando una popolazione più favorevole per i nostri suini. Questi obiettivi sono raggiunti attraverso l'uso di batteri probiotici che competono per questi nutrienti e li usano in modo più efficiente (Gerritsen et al., 2011). D'altra parte, altre strategie probiotiche si basano sull'alimentazione incrociata, che consiste nel fornire un probiotico che fornisce specifici prodotti metabolici per promuovere i batteri che più interessano. Un esempio di questa pratica sarebbe lo studio di Belenguer et al. (2006) dove, attraverso la produzione di lattato e acetato da parte dei bifidobatteri, stimolò la crescita di altri batteri butirogeni (fornendo energia ai colonociti).
Provocando cambiamenti nell'ambiente
I cambiamenti nell'ambiente fermentativo ed il pH influenzano anche il profilo del microbiota. Questo può essere raggiunto direttamente con acidificanti o, in maniera indiretta, con probiotici, per esempio, con i batteri dell'acido lattico, che producono acido lattico come un importante metabolita (Yang et al., 2015). La fermentazione dei prebiotici come i FOS o l'inulina, risulta anche nella produzione di acidi organici, che riducono il pH intestinale e ostacolano la colonizzazione da parte di enterobatteri o clostridi sensibili a questo pH acido.
Interferendo nella comunicazione batterica (Quorum Sensing)
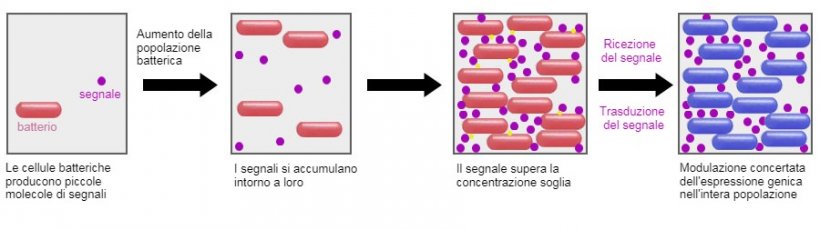
Una linea di ricerca molto promettente è quella di interferire nel Quorum Sensing (QS), il meccanismo di comunicazione tra i batteri. Questa comunicazione avviene attraverso molecole di segnalazione e consente loro di creare una risposta coordinata, attivando o disattivando l'espressione di determinati geni ed, eventualmente, agendo come collettività, fornendo benefici di sopravvivenza come la formazione di biofilm o sporulazione (Hughes e Sperandio, 2008). Usando probiotici specifici, che rilasciano altre molecole di segnalazione, o in mancanza di ciò, gli enzimi che idrolizzano le molecole di segnalazione presenti, possiamo influenzare questi percorsi di QS (Brown, 2011). Tuttavia, va detto che molte delle informazioni attualmente disponibili sulla comunicazione batterica sono a livello in-vitro, e sarà interessante vedere se i risultati dei test in-vivo sono coerenti o dipendono dall'ambiente gastrointestinale dell'animale.

Modificando i modelli di colonizzazione e sviluppo del tratto gastrointestinale
Infine, vale la pena notare che le prime settimane di vita sono una fase in cui tutte queste strategie saranno potenzialmente molto più efficaci e durature. Da un lato, è stato descritto che il microbiota neonatale è relativamente dinamico e molto influenzato dall'ambiente e dal microbiota materno. D'altra parte, la composizione microbica in questo stadio è determinante per il futuro, un fatto noto come "impronta microbica-microbial imprinting" (Konstantinov et al., 2006). A sua volta, è anche noto che il microbiota svolge un ruolo essenziale nella formazione del tratto gastrointestinale immaturo di generare sistemi funzionalmente efficienti quando l'animale è un adulto (Lewis et al., 2012). Questo è evidente in studi su animali germ-free dove gli animali descritti senza microbiota hanno un sistema immunitario ed architettura intestinale sotto-sviluppati (Luczynski et al., 2016). Inoltre, è stato anche dimostrato in studi in allevamento, dove sono stati collegati animali esposti a una maggiore diversità microbica dalla nascita con un profilo microbico più sano, adattabile a cambiamenti ambientali e più resistente ai batteri potenzialmente pericolosi (Mulder et al 2009). In conclusione, da un punto di vista pratico, la fase neonatale, incluse le scrofe riproduttrici, possono essere i momenti più efficaci per influenzare il microbiota, stabilendo benefici più solidi e duraturi (Kenny et al., 2011).




