Oggi vengono utilizzate varie tecniche di laboratorio all'avanguardia per valutare la risposta immuno-cellulare nei suini, sia utilizzando cellule del sistema immunitario del sangue (mononucleari del sangue periferico, PBMC) o cellule immunitarie derivate da organi periferici come il timo, linfonodi, milza, intestino, polmoni e midollo osseo. Queste tecniche sono di molto migliorate in veterinaria e oggi possono essere impiegate nella ricerca sperimentale o di campo. La citometria di flusso (Flow cytometry) viene utilizzata anche in oncologia dei piccoli animali.
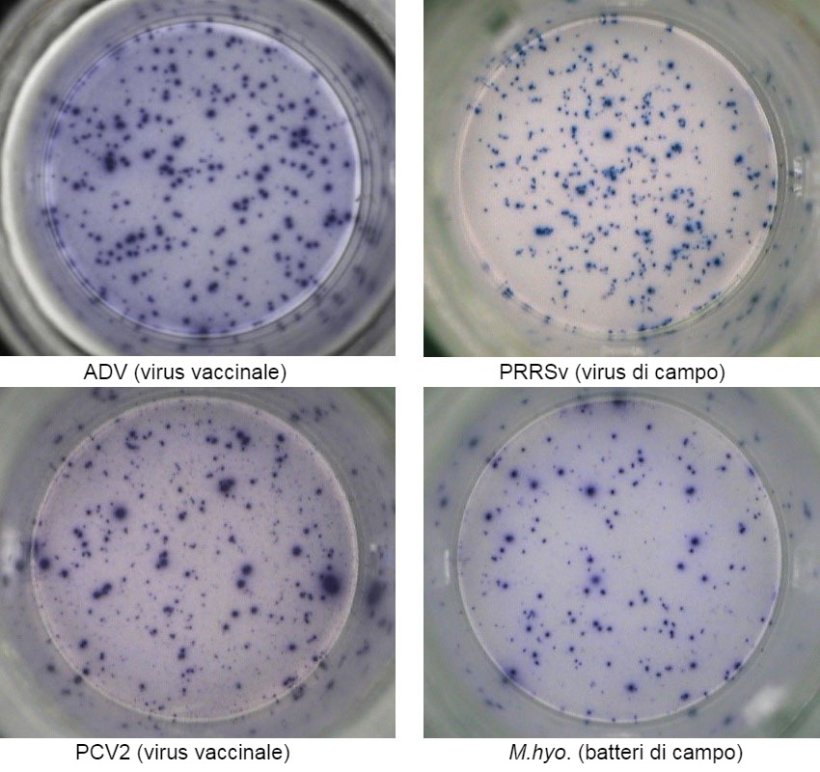
Una delle tecniche più utilizzate nel test ELISPOT di IFN- γ(interferon-gamma enzyme-linked immunospot ) mediante il quale si può quantificare il numero delle cellule secretrici di IFN-γ con una sensibilità elevata attraverso la stimolazione con un antigene virale (p.e. PRRSv, PCV2, ADV) o antigeni del micoplasma/batterici (p.e. Mycoplasma hyopneumoniae, Escherichia coli).

Le cellule PBMC vengono isolate dal sangue intero dei suini che abbiano avuto contatto con il patogeno mediante vaccinazioni precedenti e/o infezioni naturali; si prosegue con la quantificazione dei linfociti T riattivandoli con un antigene dello stesso patogeno o dal patogeno stesso (es. il virus intero).
Questo test può dare informazioni importanti sullo stato dell'attivazione del sistema immunitario del soggetto. Di fatto, l'induzione specifica mediante il virus o batteri sulle cellule di memoria e le T effettrici si identificano mediante la secrezione di IFN-γ a livello cellulare, visualizzato in 96 pozzetti.
Mediante l'uso del ELISPOT è possibile monitorare la reattività immunitaria lungo nel tempo, confrontando forme di vaccinazioni (es.. intramuscolare vs intradermica senza ago), si possono confrontare programmi vaccinali o realizzare infezioni con patogeni emergenti per valutare la risposta dei soggetti infetti e l'efficacia di nuovi vaccini in termini di protezione e di protezione crociata.
La risposta immuno-cellulare si valuta mediante il conteggio dei punti prodotti per secrezione di IFN-γ per ogni cellula individuale e normalmente si esprime come numero di cellule secretrici di IFN-γ a ogni milione di cellule analizzate. Se il campione è positivo, significa che l'animale è stato esposto all'antigene virale o batterico in campo e che per questo motivo, ha sviluppato immunità con cellule T di memoria che conferiscono un grado di protezione nei confronti di un'esposizione successiva allo stesso patogeno e/o protezione crociata nei confronti alle varianti del patogeno.
La citometria di flusso è una tecnica sensibile e specifica che permette di identificare (immunofenotipia) e quantificare le sub-popolazioni di cellule immunitarie nel sangue periferico (PBMC) o cellule isolate di tessuti o organi del sistema immunitario marcate con tinture con fluorocromo di anticorpi coniugati che reagiscono con i principali marcatori immunitari intracellulari o di superficie.
Per cui, si possono osservare e monitorare i cambiamenti in questi sotto-gruppi durante i trattamenti sperimentali specifici o in trattamenti di campo, come vaccinazioni o somministrazione di immuno-stimolanti o altri farmaci o addirittura infezioni naturali e sperimentali. Normalmente, i marcatori più utilizzati per la citometria di flusso sono le molecole CD (cluster di differenziazione) esposte sulla superficie delle cellule immunitarie, medianti le quali è possibile identificare vari sub-gruppi di monociti (es. CD172, CD14, CD16, CD163) e linfociti (CD3, CD4, CD8, CD27, CD1, CD2, CD16, CD14, CD25, CD79).
Lo stato di attivazione di queste cellule può essere determinato mediante la tintura intracellulare di molecole associate all'attivazione e la secrezione delle molecole come le citochine pro-infiammatorie (p.e. IL-1, TNF-α, IL-6), le immuno-citochine (p.e. IL-2, IFN-γ, IL-10) ed i fattori di espressione (p.e. FoxP3).
In questo modo, dopo un'infezione e usando diversi tipi di tinture, è possibile identificare e studiare subcongiunti immunologici polifunzionali capaci di produrre molteplici tipi di citochine allo stesso momento. Queste sembrano essere le cellule in grado di regolare ed eliminare i patogeni, oltre che di offrire protezione nei loro confronti.
![Figura 2. Esempi di citometria di flusso per identificare i fenotipi delle cellule immunitarie quantificate come % di valori assoluti [numero di cellule/ml di sangue]) nei suini PBMC: a-c) Sub-popolazioni di linfociti T: CD3+CD4+CD8- = Linfociti T helper (Th) CD3+CD4+CD8+ = cellule T di memoria CD3+CD4-CD8+ = linfociti T citotossici (CTL) d-e) sub-popolazioni di monociti pro infiammatori: CD172+CD14+CD16+ CD172+CD16+CD163+ CD172+CD14+CD163+ f-g) CD4+CD25+FoxP3+ = linfocitiT regolatori(Tregs).](https://www.3tre3.it/3tres3_common/art/it/8037/citometria-di-flusso_134232.jpg?w=820&q=1&t=1653979446)
La linfoproliferazione (Lymphoproliferation) dopo la stimolazione in vitro con attivatori mitogenici policlonali (aspecifici) e monoclonali (es. specifici per virus o batteri) possono essere un modo facile di valutare la reattività delle cellule T quando il suino è soggetto a trattamenti che possono alterare la risposta ai mitogeni o antigeni patogeni che attivino ed inducano un cambio da cellule dormienti a cellule proliferanti attive (ossia, linfoblasti).
La linfoproliferazione può avvalersi di un test MTT (incorporazione e cambio di colore di un reagente indotti da cellule di proliferazione), ma anche per citometria di flusso, per quantificazione dei linfoblasti (cellule di grandi dimensione) e/o incorporazione di fluorescenti dopo la stimolazione in vitro durante 2-5 giorni.
La tecnologia di tetrameri (Tetramer technology) è stata utilizzata nei suini per la quantificazione mediante citometria di flusso dei linfociti T citolitici/citotossici di memoria antigene-specifici CD8+ e, più recentemente, per la quantificazione delle cellule B di memoria antigene-specifiche.

Si basa sull'utilizzo di macromolecole fluorescenti caricate con antigeni che sono esposte ad una popolazione mista di cellule immunitarie affinchè interagiscano con le cellule B e T che riconoscono selettivamente l'antigene e presumibilmente siano responsabili dell'efficacia della risposta cellulare e dell'eliminazione/riduzione del patogeno nell'animale. Si tratta di un metodo molto specifico e sensibile che può rilevare piccole quantità di cellule di memoria B o T. Per esempio, si è sviluppato per identificare linfociti T citotossici CD8+ specifici per il virus dell'afta (FMDv) e dell'Influenza Suina (SIV) e di linfociti B di memoria specifici per il PRRSv.
I test di citotossicità utilizzano linfociti T effettori citolitici/citotossici (E) isolati in precedenza e poi incubati per 3-4 giorni in 96 pozzetti con cellule diana (T) in differenti quantità (E/T); l'efficacia della citolisi offre un'informazione sul potenziale immunitario delle cellule T effettrici contro le cellule diana in vivo potenzialmente infette.





