Le diagnosi di PRRS si sono evolute nel corso degli anni e includono diverse preziose opzioni di test. Il tipo di animali da campionare ed il tipo di procedura di campionamento dipendono dallo scenario per il quale effettueremo il test: Dobbiamo analizzare scrofe, suinetti, animali da ingrasso o tutti loro?... Stiamo conducendo un campionamento diretto o un campionamento random della popolazione?... E quale dovrebbe essere la dimensione del nostro campionamento?... Dobbiamo anche decidere il tipo di campione: stiamo prendendo siero, tessuti, fluidi orali o sperma?... E, infine, non possiamo dimenticare tutte le domande relative allo stadio della malattia al momento del campionamento. Quando sono comparsi i segni clinici?... Ci aspettiamo che il test diagnostico rilevi il virus, identifichi la lesione o rilevi gli anticorpi?... Infine, è essenziale comprendere i vantaggi ed i limiti di ciascun test diagnostico...
Comprendere le opzioni e scegliere la strategia diagnostica corretta per ogni scenario per il quale dobbiamo campionare per la PRRS, aumenterà l'efficacia di qualsiasi programma sanitario negli allevamenti.

Scenari in cui prendiamo campioni di PRRSV
Lo scenario più ovvio è per investigare la malattia, quando i sintomi di un possibile focolaio di PRRS appaiono in un allevamento negativo o stabile. In questo caso, i veterinari eseguono il test per comprendere la causa dei segni clinici e l'origine dell'agente patogeno che causa i problemi. Un altro scenario molto comune è quando si monitora l'assenza della PRRS in un allevamento precedentemente positivo ed instabile che ha intrapreso una strategia di controllo o di eradicazione e desidera analizzarne i progressi. Infine, i test PRRS sono estremamente comuni allo scopo di sorveglianza delle malattie. In quest'ultimo scenario, i test vengono eseguiti su allevamenti negativi e in genere richiedono un numero maggiore di campioni per massimizzare la confidenza (confidence) nello stato di indenne da PRRS della popolazione.
I nostri obiettivi diagnostici guideranno la scelta del test
Storicamente abbiamo classificato i test di diagnosi della PRRS in 3 tipi:
-
Quelli che rilevano la lesione: osservazioni post mortem e istopatologia, che possono essere eseguiti solo in laboratorio al microscopio. I test di screening delle lesioni sono spesso utilizzati negli scoppi di PRRS clinicamente evidenti;
-
Quelli che rilevano il virus: polymerase chain reaction (PCR), dall'isolamento del virus (VI) e test immunoistochimici (IHC). Il rilevamento virale è lo strumento diagnostico più affidabile per la conferma precoce della presenza del virus;
-
Quelli che rilevano gli anticorpi: Enzyme Linked Immunosorbent Assay (ELISA), immunoperoxidase monolayer assay (IPMA) e indirect immunofluorescence assay (IFA). La conferma immunologica del contatto con il PRRSV richiede un periodo di rilevamento più lungo, ma conferma l'esposizione quando il virus non può essere rilevato.
Imagen 1. Plato de ELISA de fondo plano con 96 pocillos usado para serología de PRRSV. Las muestras positivas se muestran en azul. Fuente: Base Pair Biotechnologies.
Le caratteristiche del test determinano il loro valore
E' molto importante revisionare la SENSIBILITA' (SE) e SPECIFICITA' (SP) quando si considerano eventuali test diagnostici. Conoscere queste informazioni aiuta a interpretare e ad agire in modo appropriato sui possibili risultati.
- SE: è la capacità di un test diagnostico di identificare correttamente campioni realmente positivi. Un test con un SE basso avrà troppi risultati falsi negativi.
- SP: è la capacità di un test diagnostico di identificare correttamente campioni realmente negativi. Un test con un SP basso avrà troppi risultati falsi positivi.
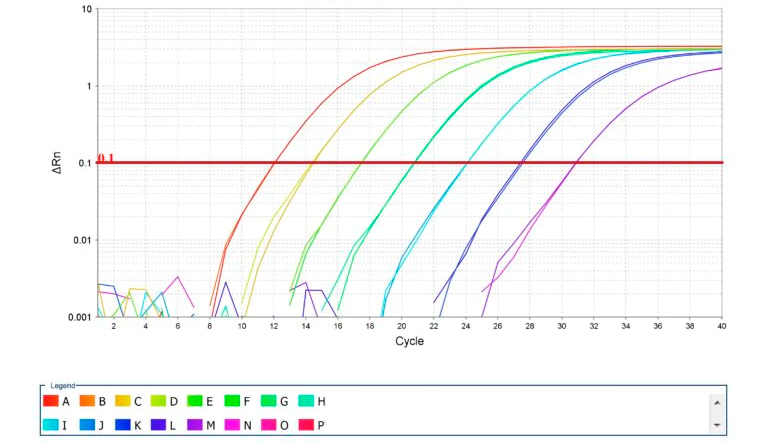
Imagen 2. Amplificación de curvas estándar para PCR cuantitativo. Fuente: Thermo Fisher Scientific Inc.
Opzioni diagnostiche in base allo scenario della PRRS
Tutti gli scenari e le opzioni diagnostiche sono riassunti nella Tabella 1.

1. Indagine sui focolai: In un allevamento che sta vivendo un focolaio, l'obiettivo del protocollo diagnostico sarà confermare l'infezione e, se possibile, caratterizzare geneticamente il ceppo. Il coinvolgimento precoce del veterinario nel focolaio aiuterà a raggiungere efficacemente questi obiettivi. Se ci sono suini con segni clinici classici, si consiglia di campionare selettivamente questi soggetti per cercare lesioni macroscopiche. Dopo aver identificato lesioni rappresentative (ad es. polmoni pesanti, non collassati, simili al marmo) in allevamento, è necessario eseguire la PCR e l'istopatologia per confermare la diagnosi. Successivamente, il sequenziamento genetico dovrebbe essere effettuato per identificare il ceppo. Il sequenziamento è la chiave per comprendere l'epidemiologia (cioè origine, residente o emergente) del possibile nuovo virus attraverso il confronto con altri ceppi noti.
2. Monitoraggio della malattia: Per ridurre al minimo l'impatto negativo della malattia a causa dell'instabilità della produzione in un allevamento PRRSV positivo, i programmi di controllo (a volte seguiti dall'eradicazione) dovrebbero essere attuati quanto prima per produrre suinetti negativi. Gli obiettivi del programma diagnostico in questo caso saranno di dimostrare i parametri chiave che indicano la stabilità della PRRS (ovvero l'acclimatazione della rimonta, l'immunità della scrofaia e la produzione di suinetti negativi). La sierologia viene utilizzata per confermare una buona esposizione dall'allevamento di scrofe e la PCR è usata per confermare l'assenza del virus nei suinetti neonati e svezzati. In queste condizioni, utilizziamo test con una alta SE (cioè il minor numero di falsi negativi possibile). Poiché abbiamo a che fare con un allevamento in cui la prevalenza prevista di suinetti positivi per la PRRS è molto bassa o assente, sarà richiesto un numero elevato di campioni per confermare lo stato di PRRS con un elevato livello di confidenza. Supponendo l'assenza di suinetti clinicamente colpiti, i suinetti selezionati a random e le scrofette negative recentemente introdotte all'interno dell'allevamento, sono le popolazioni migliori da campionare. La maggior parte dei tipi di campioni (ad es. siero, fluidi orali, emosieri e tessuti) sono preziosi, ma è importante comprendere le differenze tra SE e SP tra i test quando si valutano i risultati. Quando possibile, il "pooling" dovrebbe essere sempre considerato, per rendere l'analisi più conveniente.
3. Sorveglianza della malattia: Quando si monitora la malattia in allevamenti negativi, comunemente selezioniamo i test con la SP più alta (ovvero il minor numero di risultati falsi positivi) possibile. Questi allevamenti (ad es. Centri di inseminazione o moltiplicatori), in molte occasioni, devono documentare il loro status su base routinaria. Nel caso di allevamenti di scrofe, il test ELISA è l'opzione migliore per mostrare l'assenza di esposizione al PRRSV. È conveniente, veloce ed ha una buona SE e SP. È comune per quei allevamenti eseguire un test sierologico secondario per determinare se i loro risultati imprevisti positivi (in genere dall'1 al 2% dei campioni totali) sono veri o falsi positivi. L'Indirect fluorescence antibody test (IFA) o l'immunoperoxidase monolayer assay (IPMA), entrambi basati sulla colorazione indiretta di monostrati preparati in cellule infette, servono come test di conferma comuni per positivi ELISA imprevisti. La PCR come test di rilevazione precoce viene utilizzata in: 1) fluidi orali prima della consegna di scrofette da rimonta di maggior età; e 2) campioni di siero o di sangue di verri nei Centri di Inseminazione.
In sintesi, scegliere i test giusti, al momento giusto, negli animali giusti e interpretarli correttamente, aumenterà la velocità, l'accuratezza e il rapporto costo-efficacia delle nostre strategie diagnostiche della PRRS.
Tabella 1. Riepilogo degli scenari e delle strategie per la diagnosi.
Investigazione di un focolaio
- Status della PRRS dell'allevamento
- Instabile alla PRRS
- Trasmissione attiva del virus
- Nuova introduzione del PRRSV
- Alta prevalenza della malattia
- Obiettivi della diagnosi
- Rilevazione dell'infezione
- Identificazione del ceppo di PRRSV
- Animali
- Quelli con sintomatologia clinica
- Nati morti
- Tipi di campionamento
- Campionamento diretto
- Minor numero di animali
- Campionamenti raggruppati (“pooled”)
- Campione
- Tessuto
- Siero
- Prima opzione di diagnosi
- Necroscopia per identificare la lesione
- Pro
- “Molto veloce”
- In allevamento
- Non è caro
- Contro
- SE/SP bassa
- Seconda opzione di diagnosi
- PCR/ sequenziazione del virus per rilevare/identificare il ceppo di PRRSV
- Pro
- SE/SP alta
- Rapido, 24h
- I risultati possono essere quantificati (RT-qPCR)
- Contro
- Casi potenziali di falsi positivi dovuti a contaminazione crociata: garantire la corretta gestione dei campioni (durante il campionamento ed il processamento).
Monitoraggio della malattia
- Status della PRRS dell'allevamento
- Stabile alla PRRS
- Ceppo PRRS autoctono dell'allevamento
- Prevalenza bassa della malattia
- Obiettivi della diagnosi
- Monitoraggio della stabilità / controllo
- Monitoraggio dei programmi di eradicazione
- Animali
- Suinetti (appena nati e svezzati)
- Rimonta
- Tipi di campionamento
- Campionamento random / Alto numero di animali
- Campionamento diretto / numero inferiore di animali
- Campioni raggruppati (“Pooled samples”)
- Campioni
- Fluidi orali
- Siero
- Emosieri (Processing fluids)
- Emosieri di lingue di suinetti (Piglet tongue fluids)
- Prima opzione diagnostica
- PCR per rilevare l'antigene (RNA) da ≈7 giorni post-infezione
- Pro
- SE/SP alta
- Rapida, 24h
- I risultati possono essere quantificati (RT-qPCR)
- Contro
- Casi potenzialmente falsi positivi dovuti a contaminazione crociata: garantire una corretta gestione dei campioni (durante il campionamento ed il processamento)
- Seconda opzione diagnostica/opzione alternativa
- ELISA per rilevare anticorpi (IgM, IgG, N) da ≈14 giorni post-infezione
- Pro
- Basso costo per campione
- Risultati in 2-4 giorni
- Conferma di laboratorio della mancanza di esposizione al virus
- Contro
- SP bassa
- Non è possibile distinguere tra esposizione al virus vaccinale e virus di campo
- I risultati non possono essere quantificati
Vigilanza sanitaria
- Status della PRRS dell'allevamento
- Allevamento negativo al PRRSV
- 1. Obiettivo diagnostico
- Garantire lo status negativo
- Animali
 |
|
4. Tipo di campionamento
|
4. Tipi di campionamento
|
|
5. Campione
|
5. Campione
|
|
6a. Prima opzione diagnostica (scrofe scrofette e suinetti)
6b. Prima opzione diagnostica (rimonta)
7. Seconda opzione diagnostica
|
6. Prima opzione diagnostica
|