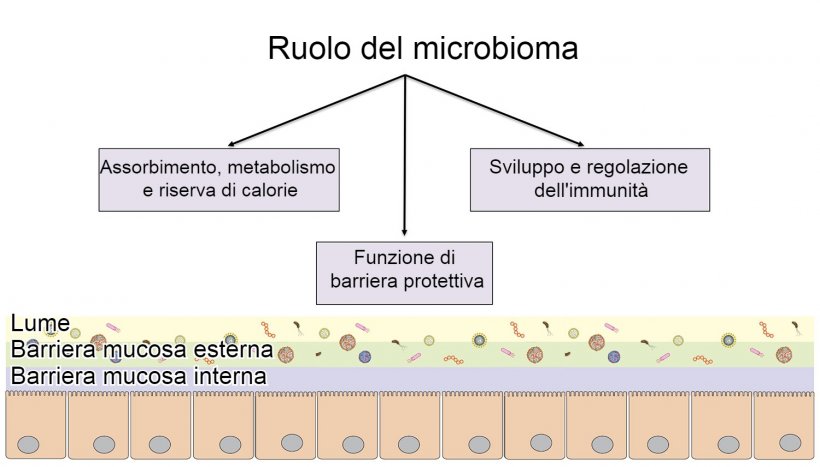
Il microbioma intestinale è il termine usato per descrivere l'insieme di microrganismi che vivono nel tratto gastrointestinale. Questi microrganismi sono molto diversi e includono virus, batteri, protozoi, funghi e archaea. È stato riportato che il numero di microrganismi nell'intestino è uguale al numero totale delle cellule dell'ospite (Sender, Fuchs et al., 2016). È importante sottolineare che il microbioma intestinale svolge almeno 3 funzioni critiche all'interno dell'ospite, tra cui: fornire una barriera intestinale protettiva, digerire e metabolizzare i nutrienti e regolare l'immunità (figura 1). La colonizzazione microbica dell'intestino del suino nelle prime settimane di vita è influenzata da molte variabili, tra cui i microbiomi vaginali, fecali e della pelle della scrofa, il consumo di latte e mangimi, l'ambiente dell'allevamento e le strutture, le infezioni virali e batteriche, le iniezioni di antimicrobici e lo stress durante la manipolazione o il trasporto. Questi eventi possono avere un ruolo nella configurazione del microbioma che il suino avrà durante tutta la sua vita produttiva (Niederwerder 2017). La relazione e l'equilibrio tra i microrganismi intestinali sono complessi e non sono ben compresi negli stati di salute o di malattia. Tuttavia, vi sono prove crescenti a sostegno del ruolo del microbiota intestinale come agente principale in presenza di malattia.

Il trapianto di microbiota fecale o FMT (per il suo acronimo in inglese, Fecal microbiota transplantation) è il processo mediante il quale le feci di un donatore sano vengono raccolte e trapiantate su un individuo malato. Simile al trapianto di organi, l'obiettivo del FMT è migliorare la salute del ricevente del trapianto. Il processo di FMT non solo trapianta microrganismi vivi e morti, ma anche piccole particelle di cibo, cellule dell'intestino tenue e crasso e prodotti metabolici di batteri (Bojanova e Bordenstein 2016). Il meccanismo con cui l'FMT è efficace non è ben definito per la maggior parte delle malattie. Tuttavia, si ritiene che i benefici derivati dal FMT siano dovuti ad un aumento dei microbi favorevoli, ad un aumento della diversità microbica ed alla stimolazione dell'immunità della mucosa (Niederwerder 2018).
Nell'uomo, l'FMT è più comunemente usato come strumento terapeutico per le infezioni ricorrenti da Clostridium difficile che non rispondono al trattamento antimicrobico (Gough, Shaikh et al., 2011). Tuttavia, l'FMT è stato recentemente riconosciuto come potenziale terapia per una vasta gamma di altre malattie nell'uomo, come la sindrome dell'intestino irritabile, la colonizzazione di agenti patogeni resistenti agli antimicrobici, la sindrome metabolica e l'insulino-resistenza. (Bakker e Nieuwdorp 2017). Negli animali, l'FMT o transfaunation, è stato anche usato come strumento terapeutico per diverse malattie, come l'infezione da parvovirus canino nei cani, nelle complicazioni post-chirurgiche di dislocazione abomasale a sinistra nei bovini e nella colite equina (Niederwerder 2018). Oltre al potenziale terapeutico del FMT negli animali, sono stati esplorati anche gli usi profilattici e immunogenici del FMT. Ad esempio, l'FMT è stato studiato come un potenziale strumento per aumentare l'efficienza dei mangimi sia negli uccelli che nei suini (Niederwerder 2018).
Nel nostro laboratorio abbiamo studiato l'uso del microbioma intestinale e del FMT nella prevenzione e controllo della malattia associata al circovirus suino (PCVAD). Il PCVAD è riprodotto sperimentalmente utilizzando un modello di coinfezione che utilizza il virus della sindrome riproduttiva e respiratoria suina (PRRSv) e il circovirus suino di tipo 2 (PCV2). Le coinfezioni da PRRSv e PCV2 sono comuni e causano significative perdite economiche nella produzione di suini in tutto il mondo. Il microbioma intestinale fornisce uno strumento alternativo per il controllo e la prevenzione delle malattie causate da queste coinfezioni. Il nostro lavoro iniziale ha mostrato che l'aumento della diversità del microbioma intestinale era associato a migliori risultati clinici dei suini in svezzamento coinfettati con PRRSV e PCV2 (Niederwerder, Jaing et al 2016, Ober, Thissen et al., 2017). Il miglioramento è stato caratterizzato da una minor sintomatologia clinica e da un maggior incremento ponderale.
Dati i consistenti benefici forniti dalla diversità microbica rispetto alle coinfezioni nei nostri lavori precedenti, abbiamo recentemente studiato l'FMT come strumento di prevenzione per la PCVAD (Niederwerder, Constance et al., 2018). In particolare, sono state raccolte feci da 2 scrofe donatrici con un elevato stato di salute e produttività, con figliate di grandi dimensioni, elevato numero di suinetti nati vivi, bassa mortalità prima dello svezzamento, senza mummificazione fetale e senza recente terapia antimicrobica. Dieci coppie di suini delle stesse figliata sono state divise tra il gruppo FMT e il gruppo di controllo. Il materiale da trapianto è stato somministrato ai suinetti per 7 giorni consecutivi prima della coinfezione con PRRSv e PCV2. I suini trapiantati sono stati confrontati con i controllo a cui è stata somministrata una soluzione salina. I nostri risultati hanno mostrato che i suini che hanno ricevuto l'FMT hanno avuto meno segni clinici associati al PCVAD, hanno ridotto la replicazione dei virus PRRS e PCV2, hanno avuto un incremento di peso maggiore e aumentato la produzione di anticorpi contro entrambi i virus (Niederwerder, Constance et al. 2018).
In generale, i microrganismi intestinali e il trapianto di microbiota fecale sono strumenti interessanti che possono essere utilizzati per migliorare la salute dei suini e prevenire malattie come quelle associate all'infezione da PCV2.






