Introduzione
Nell’ambito delle numerose ricerche volte all’approfondimento delle conoscenze nei riguardi della PRRS nella specie suina, sono stati recentemente proposti nuovi approcci alla valutazione della risposta immunitaria in campo, tra cui la valutazione degli anticorpi specifici nel fluido orale. Tale matrice diagnostica è particolarmente interessante, in quanto si presta ad una facile raccolta mediante metodi non invasivi, rispettosi del benessere animale. Tali metodi comportano inoltre un notevole risparmio di tempo di lavoro per il personale aziendale rispetto ai consueti prelievi di sangue venoso, che diventano obiettivamente di difficile realizzazione per soggetti di mole elevata.

Azienda
Lo studio è stato condotto in un’azienda suinicola a ciclo aperto del Veneto, stabile per PRRS, il cui target commerciale è la vendita di magroni tra i 30 e i 35 kg di peso vivo. L’effettivo delle scrofe presenti in produzione è di 350-400 animali al massimo. L’allevamento risulta positivo per l’infezione da PRRSV da anni. Viene effettuata una vaccinazione della rimonta prima con vaccino vivo attenuato attorno ai 140 giorni di vita e quindi un richiamo con vaccino inattivato dopo 3 settimane.
Disegno dello studio
Otto scrofette da rimonta, di 3 gruppi consecutivi, sono state marcate, raggruppate assieme e quindi seguite longitudinalmente ai seguenti tempi: T1=giorno 1 (giorno seguente all’arrivo in azienda), T2=giorno 49 (uscita dalle capannine), T3=giorno 63, T4=giorno 77, T5=giorno 91 e T6=giorno 105. A ogni prelievo è stato prelevato il sangue senza anticoagulante per ottenere il siero e raccolto il liquido orale di gruppo mediante cordino.

Prelievo in capannina il giorno dopo il loro arrivo.

Prelievo al momento di uscire dalle capannine.
Prelievo di fine esperimento, in box. Presentazione manuale della corda!

Risultati
Lo stato clinico delle scrofette è rimasto soddisfacente durante il corso dell’intera sperimentazione. Lo stesso vale per i parametri produttivi e riproduttivi dell’allevamento nell’anno in cui è stata eseguita la prova di campo (n. aborti, portata al parto, n. suinetti svezzati / scrofa / anno). Le scrofette in esame sono risultate infette da PRRSV a distanza di 7-9 settimane dall’ingresso in allevamento (Tabella 1). La cinetica di sviluppo degli anticorpi sierici è risultata in accordo con quella degli anticorpi IgA e IgG nei liquidi orali nei gruppi 1 e 2. Nel gruppo 3 la concordanza è stata verificata solo con gli anticorpi IgG dei liquidi orali.
Non è stata invece rilevata alcuna positività al saggio di Real-time RT-PCR né nei sieri dei singoli animali né nei liquidi orali di gruppo.
Tabella 1. Risposta anticorpale (siero di sangue e liquidi orali) a virus PRRS.
Gruppo 1
| Prelievo 1 (g0) | Prelievo 2 (g49) | Prelievo 3 (g63) | Prelievo 4 (g77) | Prelievo 5 (g91) | Prelievo 6 (g105) | |
| Sieri: media s/p | 0 | 0,35 | NE | 0,92 | 0,76 | 0,86 |
| Sieri positivi / totale | 0/8 | 3/8 | NE | 8/8 | 7/8 | 8/8 |
| LO: s/p test IgA | 0 (NEG) | 0,61 (POS) | NE | 0,49 (DUB) | 0,87 (POS) | 0,75 (POS) |
| LO: s/p test IgG | 0,10 (NEG) | 1,83 (POS) | NE | 1,04 (POS) | 1,16 (POS) | 1,06 (POS) |
Gruppo 2
| Prelievo 1 (g0) | Prelievo 2 (g49) | Prelievo 3 (g63) | Prelievo 4 (g77) | Prelievo 5 (g91) | Prelievo 6 (g105) | |
| Sieri: media s/p | 0,01 | 0,08 | 0,93 | 1,11 | 1,03 | NE |
| Sieri positivi / totale | 0/8 | 1/8 * | 8/8 | 8/8 | 8/8 | NE |
| LO: s/p test IgA | 0,02 (NEG) | 0,21 (NEG) | 0,91 (POS) | 0,53 (DUB) | 0,49 (DUB) | NE |
| LO: s/p test IgG | 0,12 (NEG) | 0,23 (NEG) | 0,84 (POS) | 1,09 (POS) | 0,86 (POS) | NE |
Gruppo 3
| Prelievo 1 (g0) | Prelievo 2 (g49) | Prelievo 3 (g63) | Prelievo 4 (g77) | Prelievo 5 (g91) | Prelievo 6 (g105) | |
| Sieri: media s/p | 0 | 0,05 | 0,11 | 0,89 | 0,83 | 0,75 |
| Sieri positivi / totale | 0/8 | 0/7 | 1/7 | 7/7 | 7/7 | 6/7 |
| LO: s/p test IgA | 0 (NEG) | 0 (NEG) | 0,17 (NEG) | 0,07 (NEG) | 0,27 (NEG) | 0,80 (POS) |
| LO: s/p test IgG | 0,04 (NEG) | 0,03 (NEG) | 0,28 (NEG) | 0,50 (POS) | 1,00 (POS) | 0,77 (POS) |
Prelievo 1: Il giorno dopo l’arrivo in azienda. Prelievo 2: al momento di uscita dalle capannine dopo 7 settimane. Prelievi 3-6: ogni 2 settimane, fino al giorno 105 dall’arrivo (4,5 mesi di vita). Questo schema sperimentale è stato definito per rivelare il tempo d’infezione, considerando che in capannina non avveniva alcun contatto con il virus.
LO: liquidi orali. NEG: negativo. POS: positivo. DUB: dubbio.
*1 solo campione con s/p 0,4 (valore soglia). NE: non eseguito. g: giorno.
Discussione e conclusioni
Il controllo sanitario per la PRRS basato sul prelievo dei liquidi orali si è dimostrato accurato e tempestivo a fronte di un impegno logistico e organizzativo molto ridotto rispetto ai prelievi di sangue sul singolo animale. I dati dimostrano inoltre che possono essere sufficienti 1-2 animali sieropositivi in gruppi di 8-10 per positivizzare il campione di liquido orale di gruppo. In tal senso, non si ravvisano sostanziali ritardi nell’accertamento diagnostico rispetto alle analisi sul siero di sangue. Va comunque sottolineato che la raccolta dei fluidi orali mediante cordino di gruppo va opportunamente modulata in funzione dell’età degli animali (ovvero della loro mole), sia nei tempi che nelle modalità di esposizione.
Nel nostro studio, la rilevazione della risposta anticorpale nei liquidi orali si è dimostrata assai più “robusta” rispetto alla dimostrazione del virus nel siero e nei liquidi orali stessi mediante RT-PCR. Va sottolineato che l’acclimatamento delle scrofette nel suo complesso si realizza in due periodi: A) le 7 settimane in capannina senza ricircolazione virale; B) il successivo periodo all’interno del reparto di fecondazione, dove si realizza il contatto con animali in condizioni di ipoendemia, ovvero di bassissima circolazione virale. In tali condizioni di pressione infettante molto ridotta, le scrofette non sono mai risultate positive in Real-time PCR con sonda per diversi possibili motivi: 1) Momenti di campionamento che non hanno intercettato i picchi di viremia. 2) Sonda utilizzata con troppe differenze rispetto al virus circolante (sonda tuttavia validata in azienda prima dello studio). 3) Degradazione di RNA virale prima dell’estrazione nonostante le precauzioni adottate.
E’ interessante notare che il test IFN-gamma (Dotti et al., 2011; immunità cellulo-mediata verso PRRSV) ha fornito risultati in accordo con i test anticorpali riportati in tabella 1 (dati non mostrati). Pertanto, negli allevamenti stabili è ragionevoli attendersi una sostanziale stabilità della positività anticorpale nel tempo, che dovrebbe tradursi in moderati titoli s/p ed un equilibrio tra la risposta IgA e IgG nei liquidi orali. Le condizioni sopra descritte non si verificano invece negli allevamenti instabili, dove si assiste a ripetuti cicli di infezione (vedi figura 1). In tali condizioni di instabilità, lo schema di controllo proposto rivelerà invece successivi cicli di viremia e di risposta anticorpale nei sieri e nei liquidi orali, associate a mancata risposta immunitaria cellulo-mediata (test IFN-gamma).
Figura 1. Infezione da virus PRRS in allevamento instabile
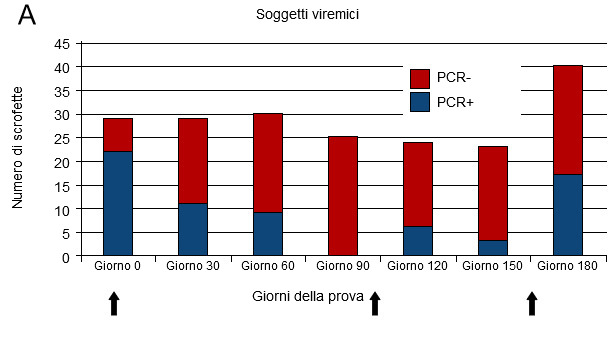
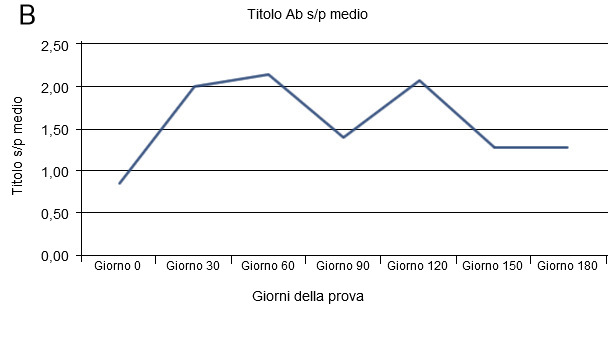
La prova di campo relativa ad un allevamento instabile per PRRS è stata pubblicata in precedenza (Dotti et al., 2013). Essa si riferisce ad uno studio di coorte su un gruppo di scrofette da rimonta. Il pannello A indica il numero di scrofette con e senza viremia ai diversi tempi. Il pannello B indica l’evoluzione dei titoli anticorpali sierici nel tempo. Le frecce nel pannello A indicano le 3 successive ondate di infezione riscontrate in azienda.







